许多人对疫苗效果持有怀疑态度,因为体内产生的抗体会在几个月内消失, 但是抗体只是体液免疫部分,还有不可忽视的细胞免疫部分, Emory的专家,解释了疫苗的重要性及免疫途径。
针对严重急性呼吸系统综合症-冠状病毒-2(SARS-CoV-2)的适应性(获得性)免疫反应是在感染后的7至10天内出现。了解B细胞及T细胞介导的对SARS-CoV-2的适应性免疫的关键特征和进化对于预测冠状病毒病-19(COVID-19)的结果以及制定控制大流行的有效策略至关重要。确定针对SARS-CoV-2的长期B细胞和T细胞免疫记忆对于理解持久保护也至关重要。
在感染的早期,已检测到了强大的记忆B细胞和成浆细胞扩增,其中症状发作后5-7天时有血清IgM和IgA抗体的分泌,而7-10天有IgG分泌。通常,血清IgM和IgA滴度在约28天后下降(图),而IgG滴度在约49天时达到峰值。同时,SARS-CoV-2在感染的第一周激活T细胞,据报道病毒特异性记忆CD4 +细胞和CD8 + T细胞在2周内达到峰值,但在观察100天或更长时间后仍可检测到较低水平。Grifoni等和其他人已从COVID-19康复的患者中,鉴定出高达100%的SARS-CoV-2特异性记忆CD4 + T细胞和大约70%的CD8 + T细胞。尽管严重(重症)的COVID-19具有高病毒滴度,但失调的先天性炎性细胞因子和趋化因子反应以及持续的淋巴细胞减少,抗体依赖性增强(ADE)或主要CD4 + TH2型细胞因子(例如IL-4,IL-5,IL-13)似乎不会与急性COVID-19严重程度有关。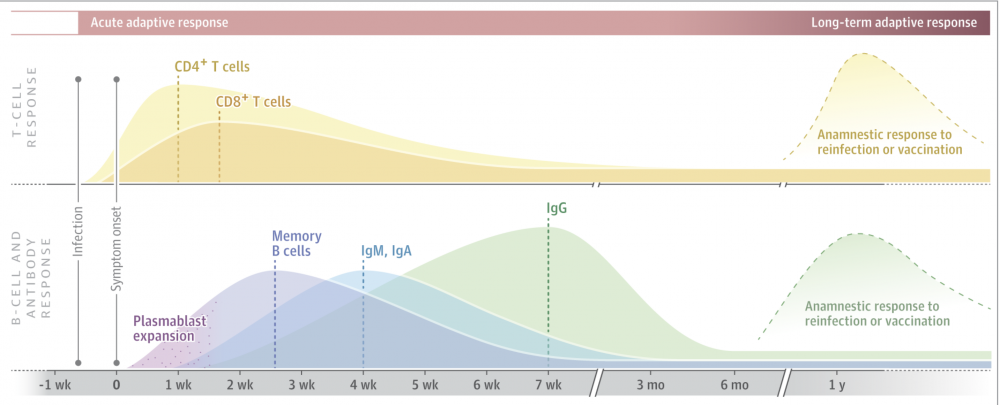
图:预计在感染后1年内对SARS-CoV-2感染的T细胞和B细胞(浆母细胞,抗体)反应的通用模型。中和抗体,记忆B细胞以及针对SARS-CoV-2的CD4 +和CD8 +记忆T细胞是由感染,疫苗接种或再暴露后产生的,是免疫途径的关键。虚线代表感染后B细胞,T细胞和抗体反应的峰值。抗体和T细胞反应的强度可能会有所不同,并且在个体之间可能不一致,并受疾病严重程度(无症状,轻度,中度或严重)影响。尚未针对COVID-19定义保护性免疫相关因子,但中和抗体,特别是那些识别病毒受体结合域(RBD)和刺突蛋白(S 蛋白)上其他表位的抗体,这些抗体可防止随后的血管紧张素转换酶II受体结合,膜融合和病毒进入是获得免疫力的一种途径。在恢复性患者中,发现抗SARS-CoV-2 刺突蛋白IgG和IgA的效价的强弱与CD4 + T细胞应答相关;IgG1和IgG3 RBD酶联免疫吸附试验(ELISA)滴度的强弱与病毒中和强烈相关。针对抵抗SARS-CoV-2刺突蛋白的中和抗体的产生是多种疫苗临床试验的基础,病毒中和也是人类临床试验中潜在的治疗性和预防性单克隆抗体作用的基础。此类病毒中和抗体在SARS-CoV-2感染的动物模型中具有保护性。强大的中和抗体和对刺突蛋白的偏向TH1的CD4 + T细胞反应可保护非人类灵长类动物的肺和鼻粘膜中的SARS-CoV-2感染,而无免疫病理性变化。SARS-CoV-2的RBD区刺突蛋白与季节性冠状病毒几乎没有序列同源性。尽管可能大家知道SARS-CoV-2刺突蛋白的变体(例如D614G),但SARS-CoV-2的变异率很低,到目前为止,此类变体没有显示出减少对抗体中和重要的RBD表位的识别的能力。最近的报道表明,恢复期针对SARS-CoV-2的IgG中和抗体的下降,增加了人们对再感染的敏感性。在感染的急性期后抗体水平总是下降的,因为在感染后的最初几周中诱导的大多数浆母细胞(B细胞的“效应”反应)是短暂的。效应子CD8 + T细胞反应观察到相似的模式。减少之后,然后通过驻留在骨髓中并在没有抗原的情况下组成性分泌抗体的少量长寿命浆细胞来维持血清学记忆。抗体回忆反应来自同样长寿的记忆B细胞库。事实上,当血清中和抗体效价低时,稀有的循环记忆细胞已显示出能产生高效的中和抗体。因此,中和抗体水平的早期下降不值得太过关注。关键是自然感染或疫苗接种后抗体效价稳定在什么水平。这代表了长寿命浆细胞的产生,以防止随后的感染。从COVID-19中康复的患者中,约有三分之一的人确实具有低抗RBD滴度和低病毒中和活性的抗体,尤其是在那些患有轻度或无症状疾病的患者中。考虑到广泛的临床疾病,COVID-19患者之间抗体反应的这种差异是可预期的。抗原负荷量是反应强度的主要驱动力,特别是在严重疾病中发现最高的中和抗体效价,但其他因素也可能涉及。基于普通感冒冠状病毒,人冠状病毒(HCoV)OC43,HCoV 229E和HCoV HKU1的免疫和再感染动力学模型,已提出对SARS-CoV-2的有限保护性免疫。在一项涉及人类对循环冠状病毒(HCoV 229E)攻击的研究中,IgG和IgA抗体在病毒鼻攻击后的第一年逐渐减弱,这表明针对普通感冒冠状病毒反复感染的保护仅持续1或2年。然而,在相同的HCoV 229E菌株进行1年的实验性再感染后,以前感染的任何人都没有感冒,所有可检测到的病毒脱落时间都较短。因此,尽管抗体迅速减弱,但至少可以保留针对临床冠状病毒疾病的菌株特异性免疫。在非人类灵长类动物中,SARS-CoV-2感染可防止再次感染。Covid-19爆发已超过8个月,而在全球范围内发生了数百万次感染之后,出现了许多零散的病例报告,这些报告大多是在最初的轻度COVID-19疾病之后出现的。尽管这些个体的完整免疫特征尚不清楚,但SARS-CoV-2的再感染表明自然的人类免疫反应可能无法提供消灭病毒免疫力,但可以缩短病毒脱落,减少扩散并预防疾病。SARS-CoV-2特异性CD4 +和CD8 +记忆T细胞也可在无症状至严重疾病的情况下产生,具有细胞毒活性并表达抗病毒细胞因子,这些特征可控制病毒复制并防止再次发生严重感染。对CD4 + T细胞反应的分析表明,TH1型为主,尽管TH17和TH2细胞因子以及细胞毒性T细胞在COVID-19急性呼吸窘迫综合征患者中的作用尚需进一步明确。据报道患有轻度或无症状疾病的个体在COVID-19感染数月后表现出强大的记忆性T细胞反应。然而,在没有检测到循环抗体的情况下,记忆T细胞是否能抵抗SARS-CoV-2尚不清楚。因此,未来在抗体出现之前和下降之后,鉴定SARS-COV-2特异的T细胞或其分子受体可能具有评估SARS-CoV-2暴露效用。目前,对T细胞在预防严重COVID-19中的作用的全面了解有限,因为使用了不同的方法来识别和分析这些反应,并且很大程度上将其用于疾病组的横断面分析。此外,研究集中在急性COVID-19中的循环T细胞反应,通常是在明显的淋巴细胞减少时期。因此,人们对其在肺和其他组织中发挥抗病毒保护作用或在恢复中发挥细胞毒性免疫致病作用的功能知之甚少。现在大量数据表明,在COVID-19大流行之前或近期在没有感染的献血者中,已经存在针对SARS-CoV-2的T细胞免疫。记忆CD4 + T细胞的发生率高于CD8 + T细胞的频率。并且这些信号可能代表先前感染过其他已知会引起普通感冒的人类地方性冠状病毒引起的反应。这样的T细胞可以识别核衣壳(N蛋白)中的已知或预测的表位,刺突结构蛋白以及非结构蛋白(NSPs),NSP7和NSP13. SARS-CoV-2反应性T细胞也可见于感染SARS-CoV-2的患者,未来的研究可能确定暴露于SARS-CoV-2后是否增强了先前冠状病毒感染的交叉反应性T细胞。如果先前存在的T细胞能够塑造针对SARS-CoV-2暴露的免疫,并在接种疫苗后影响COVID-19的严重程度,那么这些发现的生物学意义将非常重要。总体而言,这些数据表明T细胞是针对COVID-19的人群水平免疫的另一种水平。血清阳性数据(SARS-CoV-2 棘突蛋白的抗体)估计,SARS-CoV-2感染的数量可能是报告病例数的10倍。因此,迄今为止可能有4000万至5000万(占美国人口的12%至15%)感染了对SARS-CoV-2的可检测血清反应。但是,仅依靠基于人群的自然免疫力是不明智的,特别是对于那些面临更大疾病严重程度风险的人群。无论以前的免疫状态如何,使用有效的疫苗将特异性中和抗体和TH1免疫力提高至高水平,都可以进一步保护这些个体。正在研发中的COVID-19疫苗旨在预防临床感染,疾病严重性或同时防止二者,这些疫苗可在第二剂疫苗中诱导对刺突蛋白的记忆免疫反应,并可产生与来自患者的血清中所见抗体相当或更高的高水平中和抗体。为了维持抗SARS-CoV-2中和抗体的水平(循环抗体水平对于保护患者至关重要,几种疫苗可担当其责),可能需要诱导足够的CD4 +滤泡辅助性T细胞,。增强抗病毒CD8 +和TH1 CD4 + T细胞的功能,以识别蛋白质组中其他保守区域的尖峰和表位,对于限制病毒复制和控制疾病严重程度也可能至关重要。SARS-COV-2很可能像先前的冠状病毒一样,在人群中成为另一种普通感冒病毒。因此,自从认识这种病毒以来的“短短”几个月内,人们已经找到了获得COVID-19适应性免疫的2条关键途径,并且正在利用这些知识快速开发疫苗。
Article Information
Viewpoint
September 11, 2020
COVID-19 and the Path to Immunity
David S. Stephens, MD1; M. Juliana McElrath, MD, PhD2
Author Affiliations Article Information
JAMA. Published online September 11, 2020. doi:10.1001/jama.2020.16656
