
时光总是匆匆易逝,转眼间10月份即将结束,在即将过去的10月里,Nature杂志又有哪些亮点研究值得学习呢?小编对相关文章进行了整理,与大家一起学习!
【1】Nature:重大突破!抑制脂肪酸氧化可实现成年哺乳动物心脏再生doi:10.1038/s41586-023-06585-5人的心脏在出生后几乎完全丧失再生能力。因此,心肌受损---例如心脏病发作---通常会导致成年人永久性丧失功能。近日,一篇发表在国际杂志Nature上题为“Inhibition of fatty acid oxidation enables heart regeneration in adult mice”的研究报告中,来自德国马克斯-普朗克心肺研究所的研究人员如今首次在小鼠身上证实心肌细胞能量代谢的改变能够使心脏再生。因此,小鼠的心脏功能可以在心脏病发作后得到很大程度的恢复。这一发现具有开创性意义,可能能够导致全新的治疗方法。成体心脏之所以丧失再生能力,主要是因为心肌细胞在出生后丧失了分裂能力。与此同时,心肌细胞的能量代谢也发生了根本变化:它们不再从糖分(即糖酵解)中获取能量,而是主要从脂肪中获取能量。这种能量产生方式被称为脂肪酸氧化(fatty acid oxidation)。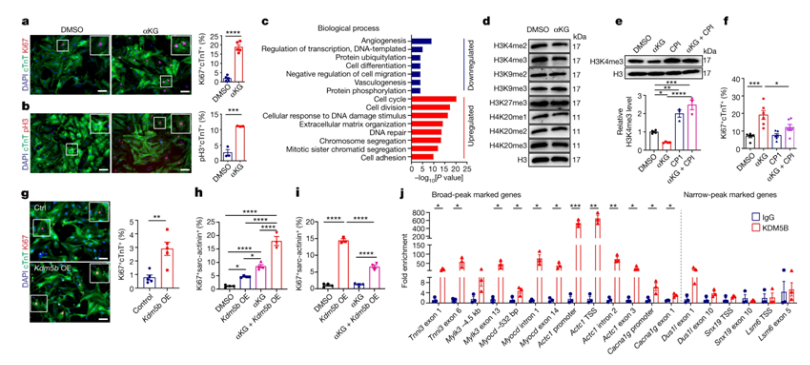
α-酮戊二酸的积累刺激了KDM5活性,减缓了心肌细胞的成熟,促进了心肌细胞的增殖图片来源:Nature, 2023, doi:10.1038/s41586-023-06585-5。研究者Thomas Braun领导的一个研究团队开始寻找促进心脏再生的新方法,研究者表示,众所周知,能够使心脏再生的动物物种主要使用糖分和糖酵解作为心肌细胞的燃料。人类心脏在发育初期也主要使用糖酵解,但随后会转用脂肪酸氧化,因为它能产生更多能量。随着出生后能量产生的转换,许多基因的活性发生了变化,细胞分裂活性也随之丧失。来自能量产生的代谢物对调节基因活性的酶的活性也有重要作用。因此,我们希望通过重编程能量代谢来引发基因活性的变化,从而重新开启心肌细胞的细胞分裂能力。”【2】Nature:1期临床试验表明基于新型溶瘤病毒的基因疗法有望安全有效地治疗胶质母细胞瘤doi:10.1038/s41586-023-06623-2胶质母细胞瘤(glioblastoma, GBM)是一种侵袭性脑癌,具有众所周知的治疗抵抗性,复发性GBM患者的生存期不到 10 个月。免疫疗法能调动人体的免疫防御系统对抗癌症,但对 GBM 却无效,部分原因在于人体免疫系统的攻击在很大程度上无法穿透肿瘤周围的环境。为了将这种免疫抑制环境转变为适合免疫反应的环境,近日,一篇发表在国际杂志Nature上题为“Targeting myeloid chemotaxis to reverse prostate cancer therapy resistance”的研究报告中,来自美国布莱根妇女医院的研究人员在一项新的临床研究中设计了一种称为CAN-3110的新型溶瘤病毒(oncolytic virus),它可以感染癌细胞并激发抗肿瘤免疫反应。他们发现基于这种新型溶瘤病毒的基因疗法对高级别胶质瘤患者具有安全性和初步疗效,并且延长了免疫上“熟悉”这种溶瘤病毒的复发性GBM患者亚群的生存期。E.Antonio Chiocca博士说,“GBM具有侵袭性,部分原因是肿瘤周围存在免疫抑制因子,这些因子阻止免疫系统进入肿瘤并对其进行攻击,从而使肿瘤得以生长。这项新研究表明,通过我们设计的一种溶瘤病毒,我们可以将这片‘免疫沙漠(immune desert)’重塑为一个促炎性的环境。”这项I期首次在人体中开展的临床试验测试了一种名为CAN-3110的溶瘤病毒的安全性,这种溶瘤病毒由布莱根妇女医院的研究人员设计并进行了临床前测试,在这项临床试验进行过程中授权给了Candel Therapeutics公司。这种攻击癌症的溶瘤病毒是一种溶瘤性单纯疱疹病毒(oncolytic herpes simplex virus, oHSV),与一种获准用于治疗转移性黑色素瘤的疗法中使用的病毒类型相同。与其他临床上使用的 oHSV 不同的是,CAN-3110包含 ICP34.5 基因,而目前临床上使用的oHSV 通常不包含 这个基因,因为在未经修饰的单纯疱疹病毒(HSV)中,它会引起人类疾病。【3】Nature:重大进展!人体临床试验证实靶向被劫持的髓系白细胞可逆转前列腺癌的抗药性doi:10.1038/s41586-023-06696-z近日,一篇发表在国际杂志Nature期刊上题为“Targeting myeloid chemotaxis to reverse prostate cancer therapy resistance”的研究报告中,来自英国伦敦癌症研究所等研究机构的研究人员发现通过阻止被劫持的髓系白细胞(myeloid white blood cell)被“拉入”肿瘤,可以在一些前列腺癌患者体内逆转这种癌症产生的抗药性。这意味着阻断这种癌症用来劫持髓系白细胞的信息可以使一部分晚期前列腺癌患者对治疗重新敏感,从而缩小肿瘤或阻止其生长。这项新的研究首次在一项人体临床试验中证实,靶向髓系白细胞--它们被肿瘤利用来助长癌症的生长、进展和抗药性---可以逆转抗药性并减缓肿瘤进展。这一发现是继十年来了解髓系白细胞如何促进抗药性产生之后的又一重大科学进步。这些作者在晚期前列腺癌患者中测试了AZD5069和恩杂鲁胺(enzalutamide)的组合使用,其中AZD5069是一种实验性药物,能阻止髓系白细胞招募到肿瘤中,而恩杂鲁胺是一种常用于治疗前列腺癌的激素类药物。在21名可评估的晚期前列腺癌患者中,有5人(24%)对这种治疗产生了反应:他们的肿瘤缩小了30%以上,前列腺特异性抗原(PSA)的循环水平急剧下降,而PSA是前列腺分泌的一种标志物,通常会因癌症而升高。此外,接受这种治疗的晚期前列腺癌患者血液中的髓系白细胞水平也有所下降,而且治疗后的活组织检查也显示肿瘤内的髓系白细胞减少。【4】Nature:新研究揭开衰老过程背后的生物学秘密doi:10.1038/s41586-023-06621-4我们如何优雅地变老---以及我们是否可以采取任何措施来延缓这一过程---一直以来都是人类所关注的问题。然而,尽管研究工作一直在进行,但我们如何才能成功对抗衰老的答案仍然难以捉摸。近日,一篇发表在国际杂志Nature上题为“Apoptotic stress causes mtDNA release during senescence and drives the SASP”的研究报告中,来自英国格拉斯哥大学和美国梅奥诊所的研究人员探讨了衰老细胞和受损细胞导致炎症的原因,以及如何阻止这一过程,以促进健康衰老,甚至改善癌症等疾病的治疗。他们揭开了衰老过程背后的一些生物秘密,并提供了一种潜在的新型治疗靶标。图片来源:Nature, 2023, doi:10.1038/s41586-023-06621-4。随着年龄的增长,我们的细胞会产生炎症蛋白,从而进一步促进衰老。癌症治疗也会通过破坏细胞而导致同样的炎症过程,进而阻碍治疗在患者身上产生良好效果。这些作者指出细胞中产生能量的细胞器---线粒体---在炎症中扮演着关键角色。他们发现,在衰老细胞中,或者在接受癌症治疗后,线粒体会发生泄漏,释放出促进炎症的DNA,从而导致衰老。他们随后发现,如果能阻止线粒体发生泄漏,就能阻止炎症,改善衰老过程中的健康状况。【5】Nature:揭示CRISPR分子剪刀的起源---转座子编码的核酸酶利用向导RNA促进转座子自身的传播doi:10.1038/s41586-023-06597-1基因组工程可能是医学的未来,但它依赖于数十亿年前在原始细菌中取得的进化进步,而原始细菌是最初的基因编辑大师。科学家们对这些古老的基因编辑系统进行改造,推动它们完成更加复杂的基因编辑任务。然而,要发现新工具,有时需要回顾过去,了解细菌最初如何创建原始的基因编辑系统,以及构建的原因。近日,一篇发表在国际杂志Nature上题为“Transposon-encoded nucleases use guide RNAs to promote their selfish spread”的研究报告中,来自美国哥伦比亚大学等机构的科学家们通过研究回顾了CRISPR-Cas9的前身---它们潜伏在所谓的“跳跃基因(jumping gene)”中---以揭示CRISPR的DNA剪刀是如何进化的。他们的发现揭示了数千种新发现的DNA剪刀是如何工作的,以及如何将它们设计成新的基因组工程技术。在细菌体内,CRISPR-Cas9 在保护细胞免受病毒感染方面发挥着至关重要的作用。在向导RNA(gRNA)的帮助下,这些分子剪刀首先识别入侵病毒的 DNA,然后切割病毒基因组。几年前,科学家们将CRISPR-Cas9的起源追溯到转座子(transposon)。转座子是一种可移动的遗传因子,也被称为跳跃基因,通过一种称为转座的神秘过程,从基因组中的一个位置跳到另一个位置。Sternberg说,“我们实验室研究的许多生物课题都是在一种生命形式从另一种生命形式中窃取基因时产生的---例如,细菌从病毒、质粒或转座子等可移动的遗传因子中窃取基因,然后这些基因被重新利用来执行类似的生化反应,但功能完全不同。”这种转座子关联性很快让人们发现了一个潜在的新编辑工具宝库:成千上万个古老的转座子仍然活跃在细菌基因组中,每个转座子都携带一种RNA引导的DNA核酸酶,基因组工程师(人类)可能对这些DNA核酸酶进行编程以便切割DNA。【6】Nature:经过基因编辑的猪肾脏可在食蟹猴体内存活长达2年doi:10.1038/s41586-023-06594-4近日,一篇发表在国际杂志Nature上题为“Design and testing of a humanized porcine donor for xenotransplantation”的研究报告中,来自美国多家研究机构的研究人员改变了几只小型猪的基因组,并将它们的肾脏移植到食蟹猴体内,以观察是否能降低排斥反应的发生几率。他们发现改变它们的基因组可以降低它们的器官移植到灵长类动物体内时发生排斥反应的几率。图片来源:Nature, 2023, doi:10.1038/s41586-023-06594-4。治疗器官衰竭患者的主要手段之一是移植来自人体供者的器官。不幸的是,这种器官供不应求。因此,科学家们一直在寻找替代方法,如利用干细胞培育新器官、利用非生物材料制造新器官或者利用动物器官。后一种方法已初见成效,但器官排斥反应(即受者的免疫系统攻击来自供者的器官)仍是一个问题。在这项新的研究中,这些作者测试了一种新方法:改变动物供者的基因组,从而降低它的器官遭受免疫排斥的可能性。具体而言,这些作者编辑了猪的 69 个基因。其中 的3 个基因参与产生与排斥反应有关的分子,59 个基因与多代之前嵌入猪基因组的逆转录病毒 DNA 有关。最后7个基因涉及添加人类基因,这些基因已知能促进器官的健康生长,比如防止不适当的血液凝固。【7】Nature:来自海洋中的危险毒素分子或有望帮助开发新型抗癌疗法doi:10.1038/s41586-023-06535-1来自海洋的环亚胺毒素(cyclic imine toxins)portimine A和portimine B因其化学结构和显著的抗癌潜力而备受科学家们的关注,然而目前研究人员还无法获得大量这些毒素,截止到目前为止,这些毒素所产生的强大活性背后的分子机制,研究人员也并不清楚。近日,一篇发表在国际杂志Nature上题为“Synthesis of portimines reveals the basis of their anti-cancer activity”的研究报告中,来自Scripps研究所等机构的科学家们通过研究发现了如何利用海洋浮游生物的毒性来制造抗癌分子;文章中,研究人员详细介绍了合成海洋毒素portimine A和portimine B的步骤,从而就能促进科学家们对其特性进行更为深入的研究调查。这些毒素目前很难大量获得,因为其唯一的生产者是一类名为Vulcanodinium rugosum的海洋浮游生物,为了测试这些毒素的活性,研究人员首先需要开发出新方法来大量合成这些毒素。合成工作从构建一种没有大部分氧原子且装饰最少得碳骨架开始,这样做的目的是利用大环的先天性活性来安装正确的氧合模式和立体化学。研究人员采用了策略性的环-链同分异构反应来促进毒素的合成,并利用闭环炔基互换反应来构建portimines分子骨架中的14元大环,这一创新性策略代表了一种可扩展且简洁的portimines合成方法,有了这一理想的分子,下一步研究人员就是观察其如何与癌细胞相互作用了。随后研究人员测试了20种人类和小鼠癌细胞系的相互作用,包括Jurkat白血病、转移性人类纤维肉瘤细胞、三阴性乳腺癌和胶质母细胞瘤脑瘤浸润细胞系;在利用portimine A评估的所有癌细胞系中,研究人员观察到了一致的强效细胞毒性,而完全合成的portimine B的治疗效果则会大大降低。在包括MC38细胞(作为结直肠癌测试模型)在内的多种癌细胞系中,portimine A被识别或能作为一种有效的细胞凋亡诱导剂,portimine A所引起的细胞凋亡对非癌细胞的影响较小,且对小鼠的毒性较低。【8】Nature:重大进展!一种新型小分子免疫治疗候选药物同时靶向肿瘤细胞和免疫细胞,有望更有效治疗癌症doi:10.1038/s41586-023-06575-7称为PD-1抑制剂的癌症免疫治疗药物被广泛用于刺激免疫系统抗击癌症,但许多患者要么对这些药物没有反应,要么产生了抗药性。正在一项早期临床试验中测试的一种称为ABBV-CLS-484的新型小分子候选药物旨在改善患者对这类免疫疗法的反应。近日,一篇发表在国际杂志Nature上题为“The PTPN2/PTPN1 inhibitor ABBV-CLS-484 unleashes potent anti-tumour immunity”的研究报告中,来自美国布罗德研究所等机构的研究人员报告表示,小分子药物ABBV-CLS-484通过两种不同的机制---使肿瘤对免疫攻击更加敏感,并增强免疫细胞的活性---来减缓肿瘤生长并提高实验小鼠的存活率。这种分子通过阻断 PTPN2 和 PTPN1 蛋白起作用,这两种蛋白通常会关闭细胞感知激活免疫细胞的信号的能力。这些作者发现,通过抑制 PTPN2/N1,该分子能将称为 T 细胞和 NK 细胞的免疫细胞变成更有效的肿瘤细胞杀手,同时也使肿瘤细胞更容易受到攻击。阻断PTPN2/N1还有助于减少T细胞衰竭,其中T细胞衰竭是T细胞功能紊乱的一种类型,被认为是对某些癌症免疫疗法产生抵抗力的根源。与包括PD-1药物在内的其他癌症免疫疗法相比,该分子的双重作用机制---同时靶向肿瘤细胞和免疫细胞---是独一无二的,这些作者认为这可能解释为什么该分子在动物模型中如此有效,甚至可能不需要与抗PD-1疗法等其他药物联合使用。【9】Nature:揭示器官自我修复机制有望带来更安全的再生疗法doi:10.1038/s41586-023-06627-y了解受损器官如何自我愈合,对于科学家们试图开发能使受伤、患病或老化的组织再生的治疗方法非常重要。这包括了解自我修复完成后如何停止。器官需要生成新细胞进行修复,但不受控制的增殖可能会导致癌症。近日,一篇发表在国际杂志Nature上题为“Cholinergic neurons trigger epithelial Ca2+ currents to heal the gut”的研究报告中,来自美国哈佛医学院等机构的研究人员通过研究揭示了神经在帮助受伤肠道完成愈合并恢复正常功能方面的作用,从而对再生如何结束提供了新的见解。
图片来源:Nature, 2023, doi:10.1038/s41586-023-06627-y。研究者表示,在再生生物学这一悬而未决的问题上取得进展令人兴奋。”这些作者是在果蝇肠道中发现这一发现的,果蝇肠道与人类肠道相似,但更容易研究。如果这一发现适用于人类,那么就可能找到更好的方法来治疗或预防因愈合不当引起的疾病,包括炎症性肠病和某些结直肠癌。研究者Petsakou表示,他们之所以选择肠道,是因为它是“最具再生能力的器官之一”,能定期修复病毒、细菌和食物中毒素造成的损伤。她给果蝇喂食了一种已知会导致果蝇和人类肠道损伤的化学物,并研究了肠道如何自我修复。她发现有一组肠道神经能检测到炎症分子,如肿瘤坏死因子,已知人类和果蝇的细胞在受到损伤时都会释放这些炎症分子。这些肠道神经的反应是将乙酰胆碱---一种具有多种作用的神经递质,包括使肠道收缩---释放到果蝇的肠道细胞中。与此同时,这些作者发现,肠道细胞通过降低一种分解乙酰胆碱的酶的水平和提高一种对乙酰胆碱有反应的蛋白的水平,增加了它们对乙酰胆碱的敏感性。这些变化导致肠道细胞之间的小通道打开,使含有正电荷钙离子的电流流过这些细胞,刺激受损肠道愈合。【10】Nature:揭示发育中的斑马鱼的心脏细胞突然开始跳动doi:10.1038/s41586-023-06561-z从少数几个细胞发展成为一个完整的生物体,并拥有功能完备的组织和器官,是一个杂乱无章但又高度同步的过程,需要细胞以精确的方式组织起来,并开始协同工作。这一过程在心脏中尤为显著,在那里静止的细胞必须开始完全一致地跳动。近日,一篇发表在国际杂志Nature上题为“A bioelectrical phase transition patterns the first vertebrate heartbeats”的研究报告中,来自美国哈佛医学院和哈佛大学的研究人员让人们得以一窥心脏细胞是如何开始跳动的。在对斑马鱼进行的研究中,他们发现,随着钙含量和电信号的增加,心脏细胞会突然同时开始跳动。此外,他们还发现,每个心脏细胞都有自行跳动的能力,不需要起搏细胞(pacemaker cell),而且心跳可以从不同的地方开始。研究者Sean Megason表示,人们如此重视心脏的跳动,以至于它长期以来一直是研究的焦点,但这是我们第一次能够以如此高的分辨率深入研究它。对于好奇心旺盛的生物学家来说,了解心跳的基本机制可能本身就很有趣,但这对于了解在调节心跳的心脏系统发育不正常或开始失灵的情况下发生了什么也至关重要。研究者Adam Cohen说道,在人的一生中,心脏大约要跳动 30 亿次,而且绝不能休息。我们想看看这台不可思议的机器是如何首次开启的。”这些作者并不是要研究心脏是如何开始跳动的。相反,他们正在寻找一个科学问题,将Cohen实验室在电活动成像方面的专长与Megason实验室在研究发育中的斑马鱼细胞如何学会交流与合作方面的兴趣结合起来。他们的研究方向直指心脏。他们意识到,尽管从亚里士多德对小鸡的观察开始,对发育中的心脏进行了数千年的研究,但心脏细胞如何开始跳动的细节仍然是一个谜,而他们有可能解开这个谜。Megason解释道,“我们想回答一个基本问题:心脏细胞是如何从静止到跳动的?心脏开始跳动是千载难逢的事件,但它是如何发生的并不明显。”生命科学综合交流QQ群:681341860
微信学科群:病毒学群,神经科学群、临床医学、肿瘤学科群、硕博交流群和医药投资交流群(微信群审核要求较高,请各位添加小编后主动备注单位研究方向)