继抗体偶联药物(ADC)爆火后,全球双抗市场日益升温。2022年下半年,6月中生制药拟10.8亿元收购双抗研发Biotech公司F-star;7月,阿斯利康以1亿美元预付款、额外8.05亿美元里程碑付款及3.6亿美元商业化付款的条款收购TeneoTwo并获得CD19/CD3双抗管线;10月,施贵宝以超过15.6亿美元的总包引进Agenus还在临床前的TIGIT双抗。
国内,越来越多的药企入局双抗,大量管线也将进入临床。市场已然有声音质疑双抗可能会步PD-1的“后尘”,但必须看到的是:一定会有Biotech凭借这波浪潮升级为Biopharma。西南证券数据显示,国内已有超过30家药企涉及双抗的研发,合计约300余款双抗在研药物,其中进入临床阶段的药物已超100款。其中,企业聚焦的靶点又以“CD3+X”、“PD(L)-1+X”为主,适应症同样聚焦在肿瘤领域。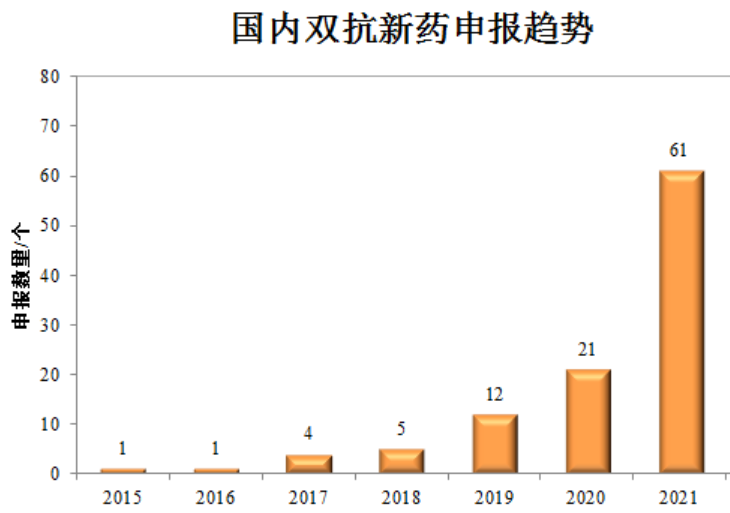
(图片来源:医药笔记)
据中银医药数据显示:全球2020年双抗交易迎来爆发,交易事件达到21起,仅交易首付款就已经达到9.5亿美元规模。而在2021年,国产双抗领域发生7款合作或交易,创下了历史新高。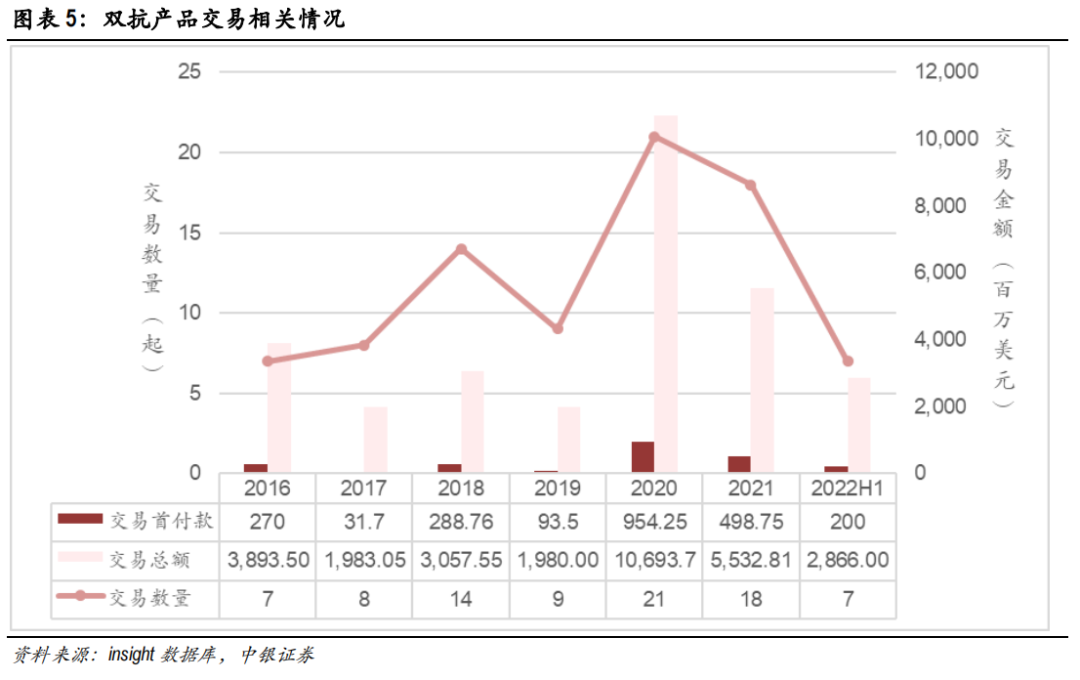
以2022年已经达成的国内License out交易为例,国内药企授出管线阶段以早期为主,例如:
● 和铂医药将临床前管线CLDN18.2/CD3双抗HBM7022授予阿斯利康,获得2500万美元的首付款、最高达3.25亿美元的里程碑付及销售分成;● 泽璟制药将临床前管线PD-L1/TGF-β双抗大中华区权益授予开拓药业,获得首付款400万美元,里程碑付款合计1900万美元及销售分成。2022年11月,翰森制药引进普米斯临床前EGFR/cMet双抗,向普米斯支付了5000万元人民币的首付款及未来高达14.18亿元人民币后续里程碑款项。可以预判,未来国内药企的后期双抗管线,一定能像荣昌将ADC授予西雅图基因一样卖个好价钱(26亿美金总包),乃至刷新授权记录。
2022年是全球双抗获批上市的爆发之年。医药魔方数据显示,截至目前今年已有4款双抗获批上市,分别为罗氏的VEGF-A/ANG-2双抗和CD3/CD20双抗、康方生物的PD-1/CTLA-4双抗、强生的BCMA/CD3双抗。除此之外,今年艾伯维的CD3/CD20双抗在10月向FDA提交上市申请,如果审批顺利,2023年我们或许能够看到全球将有3款CD3/CD20的双抗产品在市。2022年获批上市的双抗数量,等于过去10年,这意味着全球双抗管线正在迎来兑现期。
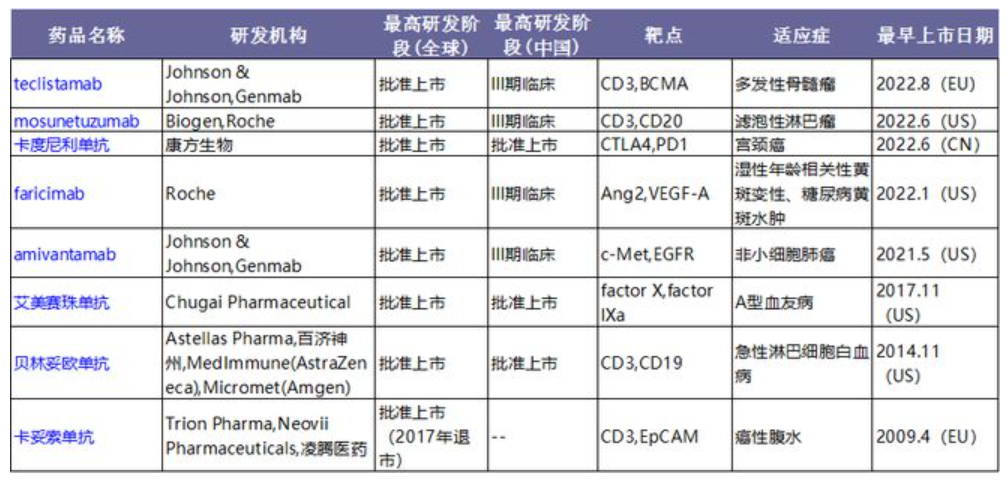
在2022年以前获批商业化的4款双抗中,首款上市产品是Trion Pharma/费森尤斯研发的CD3/EpCAM双抗,但上市后年销售额均不超过500万美元。该双抗产品销售惨淡的背后有几大原因:1)适应症为恶性腹水,昂贵的价格相比传统插管引流并无竞争力,沦为辅助用药;2)鼠源抗体杂交而成,免疫原性强,副作用大;该产品在2017年退市。销量第一的双抗产品则是罗氏的艾米珠单抗(Hemlibra),虽然作为第三个双抗获批但却是首个非肿瘤治疗双抗,其作为常规预防手段预防或减少成人和儿童A型血友病患者(伴有或不伴有Ⅷ因子抑制物)的出血事件。2021年艾米珠单抗销售额为30.22亿瑞士法郎(34.14亿美元),较2020年同比增长41.0%,成为首个双抗药物的重磅炸弹。
不难预见,双抗具备重磅炸弹药物的潜质。回看国内,国内双抗的销售开局亦出现了良好的势头。
全球第二款安进的CD3/CD19双抗(贝林妥欧单抗)国内权益授权予百济神州,于2021年8月正式商业化。2022年上半年,百济神州的安进授权产品在国内的销售额为3.84亿元,上年同期中国市场销售额总计1.15亿元,同比增长234%(涵盖贝林妥欧单抗收入)。另外,首个商业化国产双抗——康方生物PD-1/CTLA-4双抗销售开局强劲,管理层预期上市后12个月的销售目标是10亿人民币,未来2-3年在国内有望达到30亿人民币的销售峰值。
目前,国内已经有多款双抗药物处于临床三期阶段及商业化阶段,包括信达生物的PD-1/PD-L1双抗、康方生物的PD-1/CTLA-4双抗和PD-1/VEGFA双抗、康宁杰瑞的PD-L1/CTLA-4双抗和HER2双抗。
已公布的临床数据显示,部分国产厂商的双抗效果不仅优于现有的靶向治疗方案,还展现出了相较于单抗联合用药更优的优异疗效与安全性。
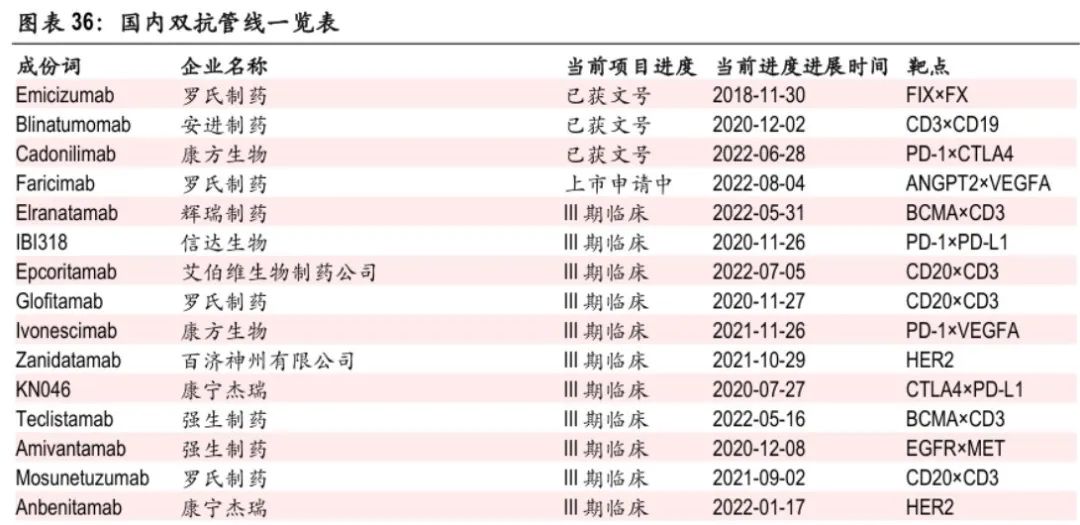
康宁杰瑞的PD-L1/CTLA-4双抗KN046已经在今年三月完成了首个临床三期(非小细胞肺癌)的中期分析(无进展生存期mPFS达到终点),原本预计在上半年报产;由于PD-1类药物数量较多,所以CDE要求其补充OS数据分析确证药物的临床获益情况,导致申报延后至2023年上半年。
不过,KN046已经在2021年ASCO公布二期临床数据中展现出更显著的安全性和疗效。在81例疗效可评估的患者中,客观缓解率(ORR)为50.6%;中位无进展生存期(mPFS)为5.9个月,中位总生存期(OS)尚未达到;12个月和15个月的生存率(OS率)均为74.9%。
相比K药而言,KN046的客观缓解率显著优胜,但中位无进展生存期略低,但在肿瘤核心获益的OS相关指标上,KN046优势明显。对于PDL1>=1%的患者,整体预计KN046的中位OS会达到约25个月,K药中位OS为16.7个月。
但值得注意的是,该试验纳入的是VI期转移性非小细胞肺癌患者,患者基线上预计较差(国内PD-1试验纳入大部分为三期患者),在ORR和mPFS相当的情况下能获得mOS获益,实属不易。
安全性方面,三级以上不良反应发生率,KN046为25.3%,K药为39%;在安全性明显好于K药的情况下,可以顺推KN046安全性亦好于PD-1和CTLA-4联合用药。
康方生物已经获批二线宫颈癌的PD-1/CTLA-4双抗AK-104,目前正在进行一线宫颈癌的大三期临床研究(已完成了445例患者入组),预计2023年底或2024年初即可提交注册,且管理层透露其在CPS小于1(免疫治疗效果不佳)的患者治疗中展现出了显著优于K药的疗效。
据数据披露,AK-104的在晚期宫颈癌全人群(不管PD-L1阳性,还是阴性)ORR为33.0%,完全缓解(CR)率达到12%,中位OS为17.51个月。而K药的ORR为12.2%,中位OS为9.4个月。(目前海外仅批了K药为晚期宫颈癌患者治疗)
宫颈癌仅仅是AK-104的开胃小菜,目前AK-104还开展了一项为胃癌的三期研究(610入组患者,目前完成90%)。在一项已经公布在ASCO的AK-104联合化疗一线治疗胃癌的Ib/II临床数据显示:在PD-L1 CPS≥1和CPS<1的患者中,中位OS(总生存期)分别为17.41个月和14.65个月。另外,在CPS≥5的患者人群中,中位OS为20.4个月,远高于PD-1信迪利单抗的15.2个月。
结语:错过了PD-1的那波大浪潮,就不要再忽视双抗、ADC等新型药物带来的迭代性机会。