今天为大家带来2023年3月份发表在国产知名期刊《Signal Transduction and Targeted Therapy》上的一篇综述“Emerging phagocytosis checkpoints in cancer immunotherapy”:肿瘤免疫治疗中的吞噬作用检查点。

喜欢看原文的同学,可以直接看文章官网链接:https://www.nature.com/articles/s41392-023-01365-z#Sec86
综述内容分为以下几个部分:
摘要
序言
1.吞噬作用检查点基本知识
2. “吃我”信号
3. 吞噬作用检查点信号通路
4. 吞噬作用检查点在免疫系统中的作用
5. 疾病和肿瘤微环境中的吞噬作用检查点
6. 靶向吞噬作用检查点及临床应用
7.结论与未来展望
今天我们先来看摘要、序言和前三点。
癌症免疫疗法,主要包括免疫检查点靶向治疗和工程免疫细胞的过继转移,利用病人自身的免疫系统与癌细胞对抗,彻底改变了肿瘤学的面貌。癌细胞通过过度表达检查点基因,劫持相应的抑制通路,逃避免疫监测。吞噬作用检查点,如CD47、CD24、MHC-I、PD-L1、STC-1和GD2,已经成为癌症免疫治疗的必要检查点,其作用是充当“不吃我”信号或与“吃我”信号相互作用以抑制免疫反应。在癌症免疫治疗中,吞噬作用检查点连接了先天性免疫和适应性免疫。这些吞噬作用检查点的基因消除以及它们的信号通路的阻断,有力地增强了吞噬作用,降低了肿瘤大小。在所有吞噬作用检查点中,CD47是研究最彻底的,并已成为癌症治疗靶点中的新星。CD47靶向抗体和抑制剂已经在各种临床前和临床试验中被研究。然而,贫血和血小板减少似乎是巨大的挑战,因为CD47在红细胞中广泛表达。在这里,我们通过讨论吞噬作用检查点在癌症免疫治疗中的机制和功能,回顾已报道的吞噬作用检查点,强调针对这些检查点的临床进展,并讨论在涉及先天和适应性免疫反应的组合免疫治疗策略方面的挑战和可能的解决方案。
一般来说,癌细胞会被人体免疫系统中的复杂系统根除,但肿瘤细胞会对抗肿瘤免疫反应产生抵抗,以逃避免疫监测。癌症免疫疗法利用病人自身的免疫系统对抗癌细胞,彻底改变了肿瘤学的面貌。它可以通过两种方式实现:免疫检查点治疗和被操纵的免疫细胞过继疗法。这两种方式都能操纵免疫系统识别和攻击癌细胞。免疫检查点抑制剂,如程序化细胞死亡配体1(PD-L1)或细胞毒性T淋巴细胞相关蛋白4(CTLA-4)的抗体和共刺激分子的激动剂,克服抑制通路释放免疫功能,在各种临床试验中取得了成功,但仍面临低反应率、高成本和非特异性毒性等问题。细胞的过继疗法主要包括基因工程细胞,包括嵌合抗原受体T细胞(CAR-T)和许多其他细胞,如多功能间充质干细胞,这些间充质干细胞被设计用来表达细胞因子和其他被操纵细胞的特征。总之,自从近年来免疫检查点阻断和CAR-T细胞疗法的临床成功以来,癌症免疫治疗已经取得了显著的进展。由于其相对于传统抗肿瘤治疗如手术、放疗和化疗的无可比拟的优势,已成为一种创新的治疗方法和强有力的临床策略。
大多数先前开发的免疫疗法主要通过刺激适应性免疫起作用,特别是通过恢复和促进T细胞反应。然而,最新的研究表明,在抗原呈递细胞(APCs)上表达的先天免疫检查点在免疫逃逸中起着至关重要的作用。这些检查点通过吞噬作用检测并消除癌细胞,且抑制先天免疫反应。发挥APCs功能的先天免疫细胞,包括巨噬细胞、单核细胞、树突状细胞(DC)和自然杀伤细胞(NK),是免疫防御系统的第一道防线。它们对外来入侵者产生促炎反应并修复受损组织。癌细胞通过过度表达被称为“不要吃我(Eat me not)”信号的抗吞噬膜蛋白来逃避巨噬细胞的清除,包括分化47簇(CD47),分化24簇(CD24),PD-L1,主要组织相容性I类复合体(MHC-I)的β-2微球蛋白(β2M)亚基,斯坦钙素1(STC-1)和GD212 (图1,2)。吞噬作用通常由内在的“吃我(Eat me)”信号促进,这些信号作为吞噬受体的配体,可以引发细胞骨架的广泛重塑并吞噬目标。
图2. 肿瘤免疫治疗中的吞噬作用检查点。巨噬细胞对肿瘤细胞的吞噬作用受多种“吃我”(促吞噬)和“不吃我”(抗吞噬)信号的调控。“不要吃我”信号在肿瘤细胞上的表达包括CD47、CD24、PD-L1、MHC-I和STC-1,它们通过与吞噬细胞上的受体相互作用来保护肿瘤细胞不被吞噬。其工作通路为CD47-SIRPα、CD24-Siglec-10、MHC-1(B2M)-LILRB1和PD-L1-PD-1。肿瘤STC-1的高表达将钙网蛋白困在线粒体和ER中,从而减少细胞表面钙网蛋白的数量,损害吞噬作用和抗原的处理和呈递,也导致T细胞反应弱。其他抗吞噬受体如SLAMF3、SLAMF4、FcγRIIB、CLEC-1等通过吞噬细胞促进肿瘤细胞的吞噬。“吃我”信号,如钙网蛋白与膜聚糖结合,位于癌细胞表面。它与吞噬细胞上的脂蛋白受体相关蛋白1 (LRP1)受体相互作用。肿瘤细胞上表达的SLAMF7和巨噬细胞上表达的MAC-1似乎都是诱导肿瘤吞噬的关键,而SLAMF7诱导吞噬的明确机制正在研究中。在这篇综述中,我们总结了迄今为止发现的吞噬作用检查点,包括基本知识、相关通路以及在癌症和肿瘤微环境中的作用。我们还讨论了这些检查点在先天和适应性免疫反应中的表达和功能。最后,我们强调了针对这些吞噬作用检查点的临床进展,列出了针对癌症免疫治疗的挑战和可能的解决方案。我们希望这篇全面的综述不仅能帮助我们了解吞噬作用检查点的研究现状,还能帮助我们开发以吞噬作用检查点为靶点,在化疗基础上建立的免疫疗法等组合治疗方法。CD47
CD47-信号调节蛋白α(SIRPα)轴,在21世纪后期被发现,是第一个肿瘤吞噬作用检查点,是一个典型的骨髓特异性免疫检查点,直接通过先天免疫起作用。CD47在肿瘤细胞上起到“不要吃我”的信号作用,抑制免疫系统中巨噬细胞的吞噬作用。无数CD47抑制剂和抗体正在研究中,其中许多正处于临床试验阶段。在临床试验中,抑制CD47对一些实体瘤和恶性血液病的疗效显著。此外,CD47-SIRPα信号通路依赖于巨噬细胞的吞噬功能,而巨噬细胞是肿瘤中浸润最丰富的白细胞。因此,靶向CD47可能代表着癌症免疫治疗的一个转折点。详细讨论CD47调控及其在癌症免疫治疗中的功能将在以下章节中介绍。CD47简史
直到2000年,CD47被视为小鼠红细胞上的“自我标记”,与吞噬细胞上的SIRPα结合。2019年,它被证实是一种肿瘤吞噬作用检查点,在免疫逃避过程中传递“不要吃我”的信号,CD47靶向抗体和抑制剂目前正在进行临床试验。CD47的结构
在免疫系统中,CD47是唯一的5-跨膜(5-TM)受体。它包含三个部分:重度糖基化n端胞外结构域 (ECD),5-TM跨结构域和短c端结构域 (CTD)。ECD包括与SIRPα结合的V-set免疫球蛋白超家族结构域。CTD可分为4种亚型,从I型到IV型,在不同细胞中表达不同。所有这些结构和剪接异构体对CD47的功能都至关重要。CD47结合蛋白
CD47与位于膜上和细胞内的其他细胞外蛋白相互作用。它的大部分功能都归功于它的结合伙伴。研究最成熟的CD47结合蛋白是血栓反应蛋白1 (TSP-1)和SIRPα。除了SIRPα,由于其细胞外结构域与SIRPα相似,SIRPγ也与CD47结合,但其亲和力低10倍。TSP-1第一个被鉴定为CD47的配体。它通过CBD结构域c端RFYVVMWK序列(4N1K)与CD47相互作用。CD47-TSP-1相互作用使血管内皮生长因子受体2 (VEGFR2)失活并抑制血管生成以抑制肿瘤生长;因此,TSP-1也被认为是肿瘤生长和转移的有效抑制剂。CD47-TSP-1相互作用也抑制炎症反应,如细胞因子分泌。巨噬细胞缺乏TSP-1限制了其吞噬能力。此外,CD47与TSP-1的相互作用通过上调干细胞的转录因子KLF4、Sox2、c-Myc和Oct4来促进干细胞的再生。SIRPα被鉴定为CD47的内源性配体。它也是一种跨膜糖蛋白,主要在巨噬细胞、单核细胞和DC上表达。它包含一个跨膜结构域,三个Ig样结构域和四个酪氨酸磷酸化位点。在细胞质中的尾部,有两个基于酪氨酸的免疫受体抑制剂基序(ITIMs)。SIRPα与CD47的相互作用是由SIRPα的n端和CD47的单个Ig-V结构域介导的。CD47的调控
CD47的表达在不同水平上受到调控。首先,Myc、缺氧诱导因子-1 (HIF-1)和核呼吸因子-1 (NRF-1)等转录因子增强了核因子κB (NF-κB) CD47的表达。此外,肿瘤坏死因子α (TNF-α)、干扰素γ (IFN-γ)和白细胞介素等细胞因子可增强CD47的表达。相反,各种microRNAs和长非编码RNA (lncRNAs)对CD47具有负调控作用。在翻译后水平,CD47的焦谷氨酰化和糖基化已经被深入研究。Lautenberg et al.,Shana et al和本课题组报道CD47是QPCTL的底物,CD47的n端区被焦谷氨酰化。QPCTL催化CD47的焦谷氨酰化反应;这种修饰对SIRPα识别CD47至关重要,并有助于它们的相互作用。CD47的细胞功能
CD47在各种生物和病理过程中发挥着重要作用。CD47的表达在胶质瘤细胞中促进或抑制细胞增殖,但在正常的星形胶质细胞中没有作用。此外,CD47增强有氧糖酵解,CD47激活有助于PI3K/Akt/mTOR致癌通路。PD-L1
PD-L1是一种程序性细胞死亡蛋白1(PD1)的配体,是一种被广泛认可的肿瘤细胞免疫检查点。针对PD1/PD-L1的抗体在临床上广泛应用于各种类型的肿瘤,PD1-PD-L1阻断开创了肿瘤治疗的新时代。因此这是靶向PD-1-PD-L1通路在肿瘤治疗中的突破。1999年,陈的团队发现了B7同源跨膜蛋白B7- h1(现在被称为PD-L1)。后来发现PD-L1是PD-1的配体,明确了PD-L1的免疫负调节功能,突出了PD-L1在肿瘤治疗中的应用潜力。2002年证实PD-L1促进T细胞凋亡,并应用B7-H1抗体抑制肿瘤生长,首次证实PD-L1在肿瘤免疫逃逸中的功能。此后,PD-L1抗体治疗的有效性通过一系列临床试验得到了证实。Cd274基因编码PD-L1蛋白,位于人类9号染色体和小鼠19号染色体上。它由一个跨膜区、典型的免疫球蛋白v型及c型细胞外域和细胞质中的短尾组成。PD-L1表达于多种造血细胞,包括DCs、巨噬细胞、B细胞和T细胞,以及其他非造血细胞,如血管内皮细胞。此外,PD-L1在不同类型的癌细胞中也经常过表达。PD-L1在正常细胞上的表达有助于调节周围的免疫反应,但其在癌细胞上的过度表达可以保护癌细胞免受免疫监测。PD-L1的表达在基因组、转录和翻译后水平上受到多种因素的调控。例如,炎症信号调节PD-L1的表达。PD-L1表达可由I型和II型干扰素、TNF-α和血管内皮生长因子(VEGF)诱导。I型干扰素IFN-α和IFN-β刺激PD-L1的表达。在前列腺癌和肾癌中,TNF-α通过激活NF-κB通路上调PD-L1的表达。II型干扰素IFN-γ与IFNGR结合并触发JAK-STAT1-IRF1调节PD-L1的表达。此外,IL-6激活JAK-STAT3或MEK/ERK信号通路,上调PD-L1的表达,TGF-β也调控癌细胞中PD-L1的表达。除炎症因子外,表皮生长因子受体(EGFR)、HIF-1、Myc、NF-κB、PTEN/PI3K-AKT和丝裂原活化蛋白激酶(MAPK)通路等致癌通路在PD-L1表达中发挥重要作用。PD-L1表达调控的机制在另一篇优秀的综述中进行了介绍,本文主要关注吞噬作用和PD-1-PD-L1轴。MHC-I
主要组织相容性复合体(MHC)是一组紧密相连的基因,高度多态性,位于哺乳动物染色体的特定区域。这些基因所编码的分子在所有有核细胞和血小板表面都有表达,而不是在红细胞上。它们参与抗原的表达,控制细胞间的识别和免疫反应的诱导。MHC的基本功能是区分“自我”和“非自我”,并将肿瘤相关抗原(TAAs)呈现给T细胞,从而激活自适应免疫应答。此外,肿瘤细胞表面的MHC-I与巨噬细胞表面的白细胞免疫球蛋白样受体b1(LILRB1)亚型结合,促进肿瘤细胞从巨噬细胞吞噬中逃逸。因此,MHC-I-LILRB1是癌症免疫治疗中的另一个吞噬作用检查点。MHC-I简史
MHC基因于1937年被发现。成功移植的关键是宿主和供体之间的组织相容性,而介导这种认识的基因叫做相容性基因。它们在同一条染色体上紧密相连,它们的产物是MHC,也被称为移植抗原,这是移植排异反应的主要决定因素。MHC位点编码经典MHC-I、MHC-II类和非经典MHC-I分子。MHC-I,作为人类第一个白细胞抗原产物,控制由蛋白质抗原引起的免疫反应。MHC-I结构
在人类中,MHC是指人类白细胞抗原(HLA),包括经典的HLA- I, HLA- II和非经典的HLA- III分子。HLA-I结合并呈现内源性抗原。人类白细胞抗原(HLA)是人类迄今为止最复杂、多态性最丰富的遗传系统,它拥有大量的等位基因,以实现对病原体最适当的免疫反应,并能够适应变化的内外环境。经典MHC-I是一种由α重链和β2m轻链组成的异源二聚体。前者链包含三个位点:三个细胞外结构区(α1、α2和α3),一个膜穿透区和一个细胞质区。α3结构区在结构上与Ig的常数区相似,是T细胞表面与CD8结合的位点。α1和α2结构区相互作用形成MHC-I的抗原结合位点,捆绑槽两端闭合。抗原肽的中间部分通常升高,并被T细胞受体(TCR)识别为T细胞表位。β2m是一种不能穿过细胞膜的可溶性蛋白质。β2m的氨基酸序列高度保守,种间差异最小,可相互取代。β2m的主要功能是稳定MHC-I分子,促进其细胞表面表达。MHC-I与吞噬细胞上的LILR1和LILRB2结合抑制吞噬作用
肿瘤细胞上的MHC-I结合LILRB1和LILRB2,它们是LILR家族的成员,属于LIR受体亚家族的抑制类。LILRBs通常在免疫抑制相关细胞中过表达,如耐受性DC和免疫抑制的M2型巨噬细胞。LILRB1表达在人单核细胞分化为未成熟DC后显著升高。随后,MHC-I分子因抗原递呈功能上调,而LILRB1下调。最近研究发现,肿瘤细胞表面表达的MHC-I的β2m与肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)表面的LILRB1结合,抑制了TAMs的吞噬活性,导致肿瘤细胞的免疫监视降低,免疫逃逸增强。MHC-I的调节
据报道,有数十个基因对MHC-I的表达有积极或消极的调节作用。正调控因子包括干扰素信号转导、mRNA加工与剪接、内质网质量控制等。负调控因子包括哺乳动物雷帕霉素靶蛋白(mTOR)调控、mRNA盖帽和翻译、多梳抑制复合体2 (PRC2)、泛素系统和大量内溶酶体运输因子,这些因子可能对MHC-I内化及其溶酶体降解至关重要。当HIV -1编码蛋白Nef存在时,MHC-I从细胞表面被移除。MIIP、CAMSAP3、SLC6A3和KCTD19可显著抑制Nef诱导的MHC-I下调。此外,还发现HLA-A2 mRNA的3'UTR与泛素E3连接酶MEX - 3C结合,导致其RING依赖性降解。CD24
已知CD24 -唾液酸结合免疫球蛋白样凝集素-10 (Siglec-10)轴可保护机体免受涉及病理性细胞死亡的致命反应的影响。最近的研究表明,用CD24抗体阻断CD24和Siglec-10的结合,可以显著增强巨噬细胞对表达CD24的肿瘤细胞的识别,CD24抗体处理后,小鼠原位肿瘤的生长明显受到抑制。因此,CD24作为一种新的抗肿瘤吞噬作用检查点被广泛研究和探索。CD24的简史
CD24作为一种热稳定抗原,于1978年首次被发现,被认为表达在未成熟的B细胞、T淋巴细胞和活化的粒细胞的膜上,作为免疫细胞分化和成熟的标志。2019年,CD24作为肿瘤细胞上的“不要吃我”信号,被发现在先天免疫系统中抑制巨噬细胞的吞噬。CD24介导细胞之间、细胞与底物之间的粘附,并在细胞识别、激活、信号转导、增殖、分化、延伸和运动等方面发挥作用。近年来,越来越多的证据证明肿瘤细胞表面CD24的表达较邻近组织明显升高,与肿瘤的发生发展呈正相关。CD24的结构
CD24基因编码一种糖化蛋白,位于染色体6q21上。成熟的CD24是一种单链涎糖蛋白,一种只有30个氨基酸的短肽。在成熟肽骨架中有一个或多个O-链糖基化位点,在CD24中有四个潜在的N-链糖基化位点。因此,CD24的糖基化修饰在不同的细胞类型之间有很大的差异,导致分子质量从35 kDa到45 kDa不等。高度糖基化的CD24需要通过糖基磷脂酰肌醇(GPI)锚定蛋白锚定在质膜内的脂筏上。CD24结合蛋白及其功能
CD24主要作为一种GPI锚定蛋白,在正常细胞和癌细胞中都位于细胞膜上,但在一些癌细胞中也分布在细胞质和细胞核中。CD24在膜上的功能取决于它的结合蛋白。它与不同的蛋白质结合,如Siglec 10, Siglec E,血小板(P)-选择素和L1-细胞粘附分子(L1-CAM),执行各种功能。由于只有CD24-Signlec 10与吞噬功能相关,我们在接下来的部分重点研究该结合蛋白。CD24与巨噬细胞上的Siglec 10结合以避免吞噬作用。Siglec 10是一种免疫抑制受体,CD24和Siglec 10之间的相互作用显著降低了与损伤相关分子模式(DAMP)相关的炎症反应及相关的损伤,包括肝损伤和败血症;这种相互作用还减少了细胞表面或内体隔室的抗原感应,减少了肿瘤相关巨噬细胞对肿瘤细胞的吞噬,从而促进了肿瘤的进展。此外,这种相互作用参与了妊娠早期母体免疫耐受的建立,也参与了自身免疫性疾病和移植物抗宿主病。CD24的调控
CD24在肿瘤中的表达受多种因素的调控。CD24在人膀胱癌中被HIF1α上调,在尿路上皮癌中被雄激素受体上调,在乳腺癌中被DNA甲基转移酶、雌激素受体和截断的胶质瘤相关癌基因同源物1上调。Twist在乳腺癌中调控CD24表达, β-catenin/TCF在结直肠癌中调控CD24表达, miR34a和miR-146a在口腔鳞癌中调控CD24表达,组蛋白去乙酰化酶(HDAC)在乳腺癌中调控CD24表达。CD24作为一种高度糖基化的GPI锚定蛋白,其在膜上的定位受到N和O糖的合成以及GPI组装相关蛋白的调控,如PIGN、PIGP和PGAP2。CD24的细胞内功能
由于GPI系统存在缺陷,如GPI组装蛋白功能缺失、GPI锚点附着弱、内质网中CD24合成错误、微囊泡中CD24包涵等,CD24可在细胞质中积累。CD24在细胞质中的定位也影响肿瘤细胞的发育。肿瘤细胞细胞质中的CD24通过破坏ARF-NPM相互作用使p53失活和不稳定,从而保护突变型p53不被降解。CD24-p53轴还通过维持肝内巨噬细胞抑制肿瘤的发生,在肝细胞癌(HCC)中可以清除DNA损伤的肝细胞。细胞质CD24在肿瘤增殖和转移中的作用一直存在争议。STC-1
STC-1于2021年被确定为吞噬作用检查点。STC-1首次在硬骨鱼类的Stannius小体中被发现,其在哺乳动物中的同源基因STC-1和STC-2随后被克隆。STC-1广泛表达于哺乳动物卵巢、前列腺、膀胱、肾脏、肾上腺、肺、心脏、子宫、垂体,在乳腺癌中表达上调,通过JNK-/c-Jun通路增强乳腺癌侵袭性。STC-1是一种糖蛋白,在调节血清钙和磷酸盐稳态中起作用。它在妊娠、哺乳、血管生成、器官生成、增殖、凋亡、缺血和肿瘤发生中起着更复杂的作用。STC-1在SUMO酰化循环中作为SUMO E3连接酶,并与位于细胞核、内质网、线粒体、细胞质、膜和分泌蛋白中的蛋白质相互作用。在糖尿病肾病中,STC-1通过AMPK/SIRT3通路抑制BNIP3,从而改善肾损伤。STC-1还通过调节VEGF水平在啮齿动物OIR模型氧诱导视网膜病变(OIR)应激反应和病理血管特征的发展中起作用。最新证据表明STC-1存在于各种人类癌细胞中。GD2
除蛋白质外,碳水化合物和脂类也参与吞噬的调节。GD2是一种二烯神经节苷,在20世纪80年代被鉴定为成神经细胞瘤的肿瘤抗原;它在成神经细胞瘤、肉瘤、胶质瘤和神经内分泌肿瘤中持续过表达,被认为是最有前途的肿瘤抗原。抗GD2抗体可延长成神经细胞瘤患者的生存期。GD2作为癌症靶点的作用已在其他地方进行了综述。GD2由五种单糖组成,含有葡萄糖、半乳糖和两个与神经酰胺相连的唾液酸残基。GD2通过其神经酰胺尾部嵌入外质膜,碳水化合物部分暴露在细胞外空间。GD2在正常组织中表达较低,局限于大脑、脊髓和皮肤黑素细胞。GD2在正常发育中的作用被认为与神经分化和修复有关,但明确的机制值得进一步研究。作为一种复杂的神经节苷,GD2通过特异性结合凝集素(如Siglecs)调节细胞-细胞识别和信号转导。GM2/GD2合成酶(B4GALNT1)缺乏的小鼠表现出中枢髓鞘形成减少,周围神经脱髓鞘和神经系统轴突变性,表明复杂的神经节苷在维持轴突和髓鞘完整性方面的作用。此外,GM2/GD2合成酶缺乏的小鼠出现了进行性行为神经病,表明GM2/GD2维持了正常的神经生理。GD2在正常细胞生理中的功能尚不清楚,但GD2可促进癌细胞增殖、粘附、迁移和侵袭,并具有抗凋亡能力。"别吃我"受体
除了上述在癌细胞上高表达的“别吃我”信号分子外,免疫细胞上还表达了许多其他“别吃我”受体,包括但不限于SIRPα、Siglec 10和LILRB1,这些受体在前面描述的信号通路中都有提及。CD22
CD22在B细胞发育早期存在于祖细胞和前B细胞的细胞质中,并在B细胞成熟时转移到B细胞表面。CD22在成熟B细胞中表达最高,因此它是B细胞恶性肿瘤和自身免疫性疾病的一个有吸引力的治疗靶点。CD22已被鉴定为小胶质细胞吞噬的抑制剂(图3a)。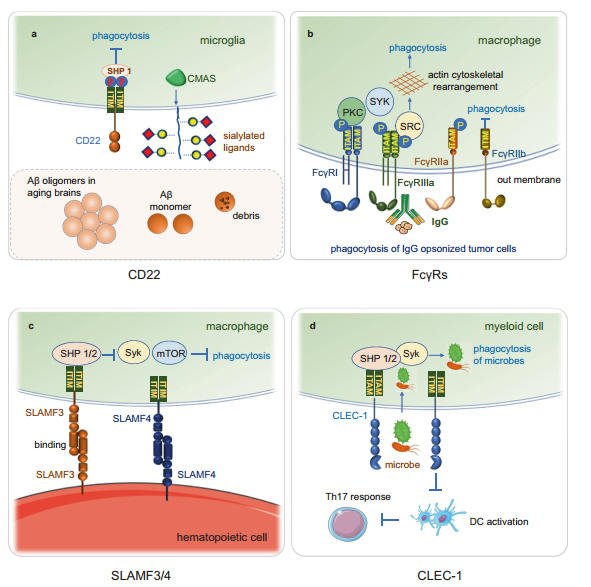
图3.吞噬受体CD22, Fc受体,SLAMF3/4和CLEC1。a CD22结合α2,6连接的唾液酸和招募酪氨酸磷酸酶SHP-1抑制小胶质细胞的吞噬能力。抗CD22治疗增强了老化大脑中注射的低聚淀粉样蛋白β (Aβ)、髓鞘碎片和α-突触核蛋白原纤维的清除。CMAS是唾液酸合成的关键合酶,与CD22的功能有关。b FcγRIIb, FcγRI, FcγRIIIa和FcγRIIa在巨噬细胞上表达。FcγRs交联IgG免疫复合物触发其ITAMs磷酸化并激活SYK、SRC和PKC通路的激酶,激酶激活导致肌动蛋白重塑,这对IgG免疫复合物的吞噬作用至关重要。FcγRIIB是唯一的吞噬抑制受体,其他家族成员是人类FcγR家族中的吞噬激活受体。FcγRIIB在其细胞质区含有一个ITIM, ITIM的磷酸化和激活招募磷酸酶SHP1和SHP2,抑制下游的吞噬作用。c SLFR在造血细胞中普遍表达。SLAMF3和SLAMF4被鉴定为巨噬细胞上的“别吃我”受体。它们抑制“吃我”信号,如脂蛋白受体相关蛋白1 (LRP1)通过含SH2结构域的磷酸酶介导的mTOR和Syk对巨噬细胞的激活,没有SFRs的造血细胞容易被巨噬细胞吞噬。d CLEC-1主要由髓系细胞表达,人DC上的CLEC-1可抑制DC激活并抑制下游Th17反应,CLEC-1是一种新型的髓系免疫检查点,可限制肿瘤细胞的吞噬作用和肿瘤抗原提呈。与微生物表面结合的CLRs通过促进炎症信号和触发细胞内信号传导诱导微生物吞噬来影响吞噬作用。CD22的表达和功能受多种分子调控。其合成酶CMAS(唾液酸合成的关键酶)和编码SHP-1的PTPN6与CD22功能相关,脾酪氨酸激酶(Syk)、磷脂酶Cγ2 (PLCγ2)、磷酸肌醇3-激酶(PI3K)、Grb2和Shc是CD22细胞质内尾部响应BCR信号的结合蛋白。CD22的配体已经在B细胞、小胶质细胞、DC和T细胞上被鉴定出来。B细胞上的CD22与小胶质细胞上的α2,6连接唾液酸结合,招募酪氨酸磷酸酶SHP-1抑制小胶质细胞的吞噬能力。抗CD22治疗增强了老化大脑中注射的低聚淀粉样蛋白β (Aβ)、髓鞘碎片和α-突触核蛋白原纤维的清除。长期CD22阻断改变了小胶质细胞的转录谱,包括与小胶质细胞稳态相关的基因,并改善了老年小鼠的认知功能。CD22介导的吞噬作用在TAMs和癌症免疫治疗中的作用有待进一步研究。此外,DCs和骨髓来源的未成熟DCs (iBMDCs)表达CD22的糖基配体,并且iBMDCs通过CD22依赖机制导致BCR诱导B细胞增殖的强烈抑制。在Toll样受体(TLR)刺激过程中,BMDCs还抑制B细胞亚群的增殖和分化。因此,CD22是介导适应性和先天免疫反应的受体调节因子。CD22与T细胞上的配体结合并影响T细胞的活化。此外,CD22调节B细胞对T细胞独立的2型抗原(TI-2 Ags)的反应。CD22也负向调节TLR通路,CD22−/−B细胞对TLR3、TLR7和TLR9激动剂的反应显示出增强的增殖能力。在机制上,CD22在B细胞中通过细胞内信号传导抑制TLR信号,CD22的天然配体似乎不影响对TLR激动剂的增殖反应。CD22在维持人体免疫B细胞稳态中起着关键作用。在抗原介导的BCR交联过程中,CD22磷酸化的ITIMs募集酪氨酸磷酸酶SHP-1。CD22敲除B细胞诱导反应,如B细胞增殖和抗体产生所需的细胞内钙动员。CD22还调节循环B细胞向骨髓的迁移,CD22缺失的B细胞通过CD22- SHP1轴减少整合素表达来抑制向Peyer's斑块的归巢。CD22是最常见的抗原之一,在血液系统恶性肿瘤中高度表达,包括人类B细胞淋巴瘤和白血病。婴儿B前体白血病细胞外显子12缺失促进其生长和存活。此外,CD22有助于预防致病性感染,CD22缺陷小鼠对感染极其敏感。此外,CD22表达与自身免疫性疾病密切相关,在系统性红斑狼疮(SLE)患者中,CD22水平降低,经有效治疗后升高。Fc 受体
通常,I型Fc共同γ受体(FcγRs)分为激活型和抑制型。激活的FcγRs包括FcγRI、FcγRIIa、FcγRIIc和FcγRIIIa,均含有免疫受体酪氨酸激活基序(ITAMs);FcγRIIB是人类FcγR家族中唯一的吞噬抑制受体,其他都是吞噬激活受体。FcγRIIB在其细胞质区包含一个ITIM, ITIM的磷酸化和激活招募了磷酸酶SHP1和SHP2,并抑制其下游的吞噬作用(图3b)。FcRs存在于不同的免疫细胞上,如单核细胞、巨噬细胞、DC和中性粒细胞,并且FcγRs个体或组合的独特表达模式平衡细胞免疫反应。FcγRIIb, FcγRI, FcγRIIIa和FcγRIIa在巨噬细胞上表达。IgG免疫复合物对不同亚型的IgG激活FcγR信号,具有复杂的结合特异性和亲和力在这些免疫复合物连接后,ITAMs被SRC家族的激酶磷酸化,它招募SYK家族的激酶,然后激活许多下游靶点来激活免疫反应,ADCC或吞噬作用。FcR功能对癌症的治疗非常重要,特别是在癌症治疗中使用免疫检查点阻断药物时。通过针对不同的治疗环境设计抗体,有可能选择性地利用FcR激活或调节免疫功能。信号淋巴细胞激活分子(SLAM)家族受体(SFRs)
信号淋巴细胞激活分子(SLAM)是重要的免疫调节受体,在免疫、细胞存活、淋巴细胞发育和细胞粘附等方面具有关键功能。SLAM家族受体(SFRs)属于免疫球蛋白超家族,在造血细胞(包括巨噬细胞)上广泛表达,调节这些细胞的激活和细胞毒性。它们将自己视为自配体,因此会经历抑制巨噬细胞吞噬作用的同型相互作用,没有SFRs的造血细胞很容易被巨噬细胞吞噬。SFR成员LAMF3和SLAMF4被鉴定为巨噬细胞上的“不要吃我”受体。它们通过含SH2域磷酸酶抑制巨噬细胞的“吃我”信号(图3c)。SFRs是区分HSC及其祖细胞的标记物,并防止自体HSC的不恰当吞噬。成熟的RBCs表达高水平的CD47,以避免巨噬细胞吞噬。SFRs可以与CD47通路结合发挥功能,也可以独立于CD47发挥作用,缓解巨噬细胞吞噬。SLAMF3也在癌细胞中表达,但其在癌症免疫治疗中的吞噬作用仍不清楚。C型凝集素样受体-1 (CLEC-1)
C型凝集素样受体(CLRs)是主要存在于髓细胞上的跨膜受体家族。它们在宿主防御中识别病原体部分,并修改自身抗原。CLR在细胞表面至少有一个C型凝集素样结构域(CTLD)和一个跨膜结构域或一个短的细胞内信号尾巴,可以促进与介导信号的FcRγ的相互作用。与微生物表面结合的CLRs通过促进炎症信号和触发细胞内信号传导诱导微生物吞噬来影响吞噬作用。C型凝集素样受体-1 (CLEC-1)是一种典型的CLR,是存在于中性粒细胞、DC和髓样巨噬细胞上的抑制性受体。人类DCs上的CLEC-1抑制DC激活并抑制下游Th17反应。CLEC-1缺陷小鼠通过联合细胞毒性和免疫原性化疗来根除结直肠肿瘤,而CLEC-1阻断抗体可以增强DCs和巨噬细胞对CLEC-1阳性肿瘤细胞的吞噬作用。CLEC-1可能是一种新的治疗药物,可调节移植、自身免疫和癌症中的免疫反应。CLEC-1是一种新型的骨髓免疫检查点,可限制肿瘤细胞吞噬和肿瘤抗原提呈(图3d)。“吃我”信号是指在细胞上表达或释放的分子,通过吞噬细胞诱导吞噬。大多数“吃我”信号位于细胞表面,但也有一些信号可能会释放到细胞外并与目标细胞结合。凋亡细胞的脂质磷脂酰丝氨酸、胞内粘附分子ICAM-3、Annexin-I、Calreticulin、细胞表面结合的血小板蛋白、补体因子、氧化低密度脂蛋白及其他糖基化改变是“吃我信号”,这些信号已经在前文中提及。巨噬细胞或DCs调控肿瘤细胞的吞噬过程,通过受体配体轴发出大量的前吞噬(“吃我”)和反吞噬(“不要吃我”)信号。上述所有的检查点都是抗噬细胞蛋白或信号分子。“吃我”信号主要包括因致癌应激而产生的肿瘤相关抗原、ER伴随蛋白Calreticulin、糖蛋白SLAMF7。Calreticulin(钙网蛋白)
钙网蛋白是一种ER驻留蛋白,在不同的细胞过程中起着作用,如应激中,它起着辅助和Ca2+缓冲的作用,帮助蛋白质进行适当的折叠和糖化。钙网蛋白对吞噬有很高的贡献,野生型钙网蛋白功能的丧失有利于肿瘤的发生,因为健康细胞内的细胞平衡受损,以及自然和治疗驱动的免疫监测受损。通过与膜甘油酯结合,卡瑞醇被固定在癌细胞表面,与吞噬细胞上的低密度脂蛋白受体相关蛋白1(LRP1)受体相互作用。LRP1可以招募包含适配器蛋白PTB域的适配蛋白1(GULP1),进一步调节吞噬过程(图4a)。钙网蛋白转运到细胞膜,作为“吃我”信号,促进凋亡细胞(包括受损细胞、老化细胞和恶性细胞)的细胞凋亡,并导致这些细胞被清除。在无数的人类癌症中,钙网蛋白已被证明是主要的亲噬细胞信号,并被CD47平衡。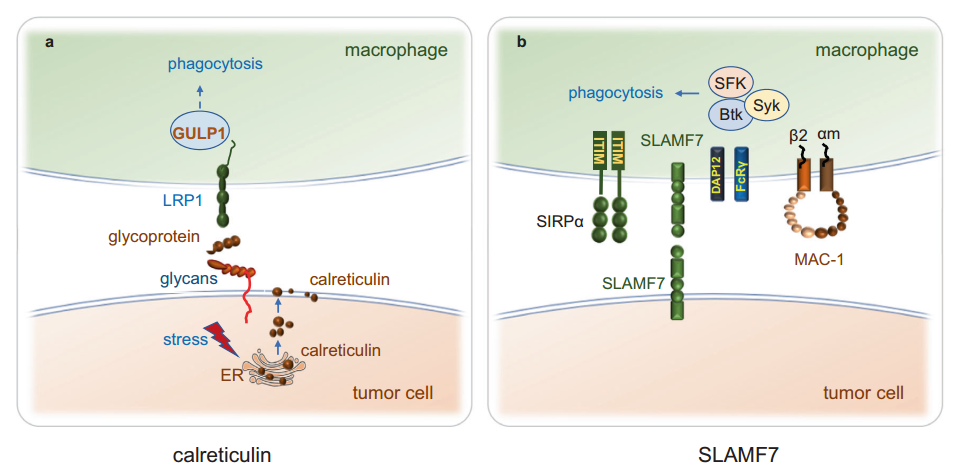
图4.“吃我”信号Calreticulin和SLAMF7。a应激和死亡的肿瘤细胞从ER上将Calreticulin暴露到细胞表面,细胞表面Calreticulin与吞噬细胞上的LRP1结合。LRP1可以招募GULP1,一个调节进一步吞噬过程的LRP1适配蛋白。b巨噬细胞上的SLAMF7与巨噬细胞上的MAC-1结合,MAC-1与FCRγ和DAP12相互作用,招募Src家族Syk和Btk激酶,促进吞噬作用。巨噬细胞上的SLAMF7与巨噬细胞上的SIRPα结合可能会影响CD47-SIRPα轴,血液病癌症中的SLAMF7结合吞噬细胞上的SLAMF7,是吞噬作用所必需的。SLAMF7与MAC-1协同,促进吞噬作用
SLAMF7,也被称为CD319、CS1或CRACC,是SLAM受体家族的成员,存在于肿瘤细胞和免疫细胞上,包括NK细胞、B细胞、DC和活化的CD4+和CD8+ T细胞。巨噬细胞上的SLAMF7识别造血细胞上的同型SLAMF7介导吞噬作用。SLAMF7缺陷的巨噬细胞,而不是其他SFRs缺陷的巨噬细胞,在吞噬作用方面存在缺陷。巨噬细胞上的SLAMF7与巨噬细胞上的整合素巨噬细胞1抗原(MAC-1)相互作用,促进巨噬细胞吞噬癌细胞。MAC-1是一种补体受体(CR3),含有α- CD11b亚基(αm)和β- CD18亚基(β2);它与ITAM、FcRγ和DAP12相互作用,通过Src、Syk和Bruton’s tyrosine kinase (Btk)固有信号通路介导免疫细胞活化,并通过IgG介导的FcR通路增强吞噬作用(图4b)。巨噬细胞上表达MAC-1对于癌细胞的SLAMF7依赖性吞噬是必要的。CD47介导的吞噬作用是否需要SLAMF7存在争议。Chen等研究表明,在CD47-SIRPα轴阻断过程中,造血肿瘤细胞的吞噬作用严格依赖于SLAMF7,但He等报道称,SLAMF7在CD47介导的吞噬作用中并不需要。鉴于这些有争议的研究结果,SLAMF7在巨噬细胞吞噬中的作用还有待进一步研究。CD47-SIRPα信号通路
CD47-SIRPα通路的机制
SIRPα的细胞内区域包含一个ITIM,它对受体的活性抑制至关重要。当含有ITAM的受体被触发时,含有ITIM的受体SIRPα抵消细胞激活。SIRPα对这一信号通路的抑制需要酪氨酸残基在细胞质ITIM序列中的磷酸化,然后招募并激活含有SH2结构域的蛋白酪氨酸磷酸酶SHP-1和SHP-2。SHP-1和SHP-2的募集磷酸化肌球蛋白IIA,抑制非肌球蛋白IIA,调节巨噬细胞中吞噬溶酶体的生物生成并在吞噬作用中发挥作用。巨噬细胞中肌球蛋白IIA去磷酸化后,肌动蛋白发生解聚,导致吞噬作用减少(图5a)。CD47在肿瘤细胞上和SIRPα在吞噬细胞上的结合促进了Src家族激酶SHP-1和SHP-2对SIRPα中的ITIM的磷酸化,从而有助于减少吞噬作用。 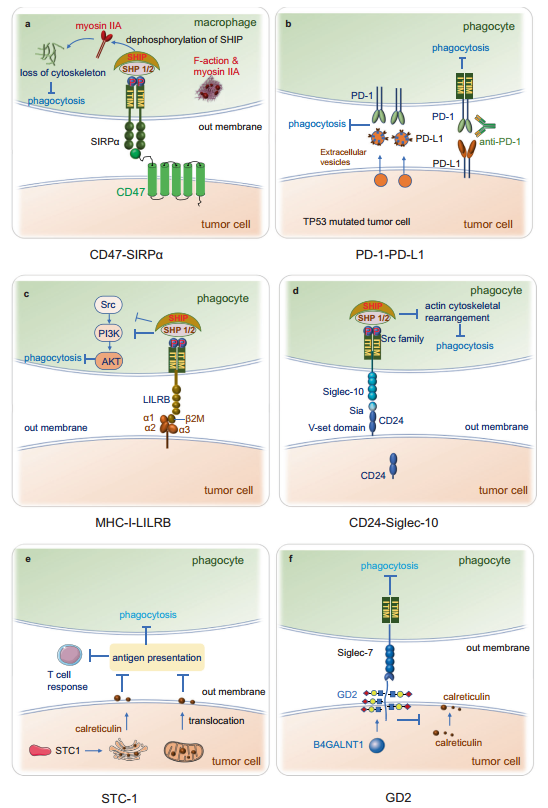
图5. 肿瘤细胞表面的CD47与巨噬细胞细胞膜上的SIPRα结合。这种相互作用促进了Src家族激酶SHP-1和SHP-2对SIRPα中ITIM的磷酸化。SHP-1和SHP-2的募集使肌球蛋白IIA磷酸化,抑制非肌球蛋白IIA的功能,巨噬细胞中肌球蛋白IIA去磷酸化后,肌动蛋白发生解聚,导致吞噬作用受限。b TP53突变增加了细胞外囊泡上PD-L1的表达,导致巨噬细胞对肿瘤细胞的吞噬作用被阻断。c MHC-1的β2M结合到LILRB1的细胞外区域,与MHC-I重链形成复合物,这种新型的抑制性MHC-I-LILRB1轴抑制先天免疫系统。d巨噬细胞表面的抑制性受体Siglec-10与癌细胞上的配体CD24结合,导致Siglec-10细胞质域的ITIM或ITIM样基序与Src家族激酶结合。Src家族激酶在细胞质中磷酸化ITIM酪氨酸,然后招募SHP-1/ SHP-2。SHP-1可特异性结合细胞内磷酸化的ITIM结构域,使其去磷酸化,导致细胞骨架重塑和吞噬抑制。e STC-1与“吃我”信号Calreticulin相互作用,取消巨噬细胞的膜性Calreticulin定向吞噬作用,从而损害巨噬细胞向T细胞的抗原提呈。肿瘤STC-1是肿瘤内在抵抗肿瘤免疫的关键,它将Calreticulin困在线粒体和ER中抑制巨噬细胞功能,促进肿瘤细胞免疫逃避和免疫治疗抵抗。f GD2(由B4GALNT1酶产生)结合吞噬细胞上的Siglec-7(抑抑性免疫受体)在巨噬细胞中触发“不要吃我”信号,Calreticulin是肿瘤细胞表面的“吃我”信号,GD2的连接导致Calreticulin上调,表明GD2可能抑制Calreticulin信号。CD47-SIRPα通路的功能
研究最多的CD47-SIRPα的功能是在癌症免疫治疗过程中诱导肿瘤免疫逃逸(图6a, b)。癌细胞高度表达CD47,它与吞噬细胞上的SIRPα结合,导致其逃避免疫监测。CD47抑制巨噬细胞的吞噬功能,刺激细胞-细胞融合,激活T细胞,影响中性粒细胞的迁移。此外,CD47在年轻红细胞和造血干细胞(HSC)上高表达,以保护它们不被吞噬,而受损和衰老的红细胞被巨噬细胞吞噬,因为它们的CD47表达低于年轻红细胞。靶向CD47或抑制CD47-SIRPα信号通路可使巨噬细胞吞噬HSC和红细胞(图6c, d)。CD47除了在大部分肿瘤细胞中发挥作用外,还在癌症干性维持和癌症干细胞(CSCs)的免疫抵抗中发挥重要作用。此外,CD47-SIRPα相互作用也激活缺血/再灌注(IR)应激后间充质干细胞(MSC)处理的肝脏中的SMO/GLI家族锌指1(Gli1)通路,该通路的激活调节细胞生长、分化和免疫功能。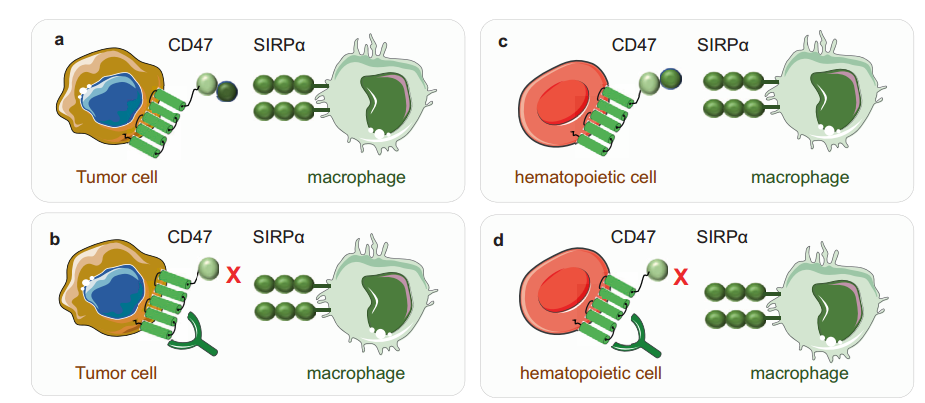
图6. CD47-SIRPα通路。肿瘤细胞上表达的CD47与巨噬细胞和其他吞噬细胞上表达的SIRPα相互作用,以避免免疫监视。b靶向CD47或阻断CD47-SIRPα轴会中断它们的相互作用,并允许巨噬细胞吞噬肿瘤细胞。c造血细胞或红细胞上表达的CD47与巨噬细胞等吞噬细胞上表达的SIRPα相互作用,避免被吞噬。d靶向CD47或阻断CD47-SIRPα轴允许巨噬细胞吞噬造血细胞,从而带来贫血等副作用。PD-1-PD-L1轴在吞噬作用中的机制和作用
作为T细胞免疫检查点,PD-1-PD-L1轴在T细胞中的功能已被很好地阐明;然而,最近的研究表明,该作用轴也在调节TAM的吞噬能力中发挥作用。PD-1不仅在外周组织的T细胞中表达,还在B细胞、活化单核细胞、DC和NK细胞中表达。与脾巨噬细胞或循环单核细胞相比,TAMs表达高水平的PD-1,且植入后PD-1表达随肿瘤体积增加而增加。此外,PD-1倾向于促进巨噬细胞向M2极化,大多数PD-1+ TAMs是M2样巨噬细胞,被认为是肿瘤微环境(肿瘤微环境)中的促肿瘤种群。骨髓移植实验表明,大多数PD-1+ TAMs来源于循环白细胞,而不是常驻免疫细胞。与PD-1-TAMs相比,PD-1+ TAMs的吞噬能力降低,表明PD-1在TAMs上抑制吞噬。PD-L1缺乏显著增加PD-1+巨噬细胞的吞噬作用,但对PD-1−巨噬细胞的吞噬作用无影响。使用抗PD -1阻断剂或PD-L1抑制剂(HAC,一种缺乏Fc结构域以消除Fc介导的吞噬干扰的工程小蛋白)阻断PD-1-PD-L1信号可以增加巨噬细胞的吞噬,并增加缺乏T细胞的NOD SCID γ (NSG)小鼠的存活率,这表明PD-1-PD-L1吞噬作用检查点的抗肿瘤作用。此外,TP53突变的肿瘤细胞分泌更多的胞外囊泡,巨噬细胞吞噬能力受损,而阻断TP53突变细胞胞外表面的PD-L1可恢复巨噬细胞的吞噬能力,提示PD-1-PD-L1在TP53突变肿瘤中对巨噬细胞吞噬的重要作用(图6b)。PD-1-PD-L1轴对肿瘤巨噬细胞有直接作用。这一证据表明,PD-1不仅抑制细胞毒性T细胞活性,还抑制巨噬细胞吞噬,揭示了PD-1-PD-L1轴在巨噬细胞吞噬中的新机制。此外,LPS刺激TLR4信号通路可上调巨噬细胞中的PD-1。PD-L1在巨噬细胞中连接PD-1增强了耐受性STAT6依赖巨噬细胞的极化和随后的肿瘤生长。在T细胞中,PD-1与其配体结合后,ITIM的酪氨酸和PD-1细胞内结构域的免疫受体酪氨酸基开关基序(ITSM)被磷酸化,从而招募含有SH2结构域的酪氨酸磷酸酶SHP-1和SHP-2,下调TCR信号通路抑制T细胞的激活和增殖。因此,巨噬细胞上的PD-1也可能触发免疫抑制信号,抑制巨噬细胞的吞噬作用;但具体机理有待进一步研究。MHC-I-LILRB1轴的机制
巨噬细胞上的LILRB1与肿瘤细胞上的MHC-I的接触位点位于保守的α3结构域和β2M亚基,而不是MHC-I高度多态性的α1和α2结构域以及LILRB1的1和2 Ig结构域(图5c)。LILRB1包含一个具有四个Ig样结构域(D1-D4)的细胞外区域,跨膜结构域和一个含有四个ITIM的细胞质尾部,这些ITIM募集SHP-1酪氨酸磷酸酶(SHIP), LILRB1通过细胞质长尾部的ITIM触发抑制信号。具体来说,(1)LILRB1与MHC-I结合导致ITIM磷酸化;(2)经Src家族蛋白酪氨酸激酶磷酸化酪氨酸残基后,磷酸化的ITIM募集磷酸酶SHIP。两个疏水残基对称地位于LILRB1的ITIM磷酸化酪氨酸残基的N端和C端,它们影响ITIM与磷酸酶的结合能力。(3) SHIPs的募集导致ITAM酪氨酸激酶失活,从而抑制了Syk/ZAP70激酶家族的ITAM募集,导致PI3K/AKT的激活。(4)上述过程促进癌细胞增殖,负向调节免疫细胞功能,抑制巨噬细胞的吞噬作用。MHC和MHC-I-LILRB1通路的功能
MHC-I在器官移植中的作用首先被报道。后来,MHC-I在免疫中的更多功能被探索。MHC-I在肿瘤免疫治疗中的主要功能是抗原呈递和诱导免疫反应。抗原表达
MHC-I的基本功能是向CD8+ T细胞显示抗原并激活获得性免疫反应。MHC-I结合并呈现内源性抗原肽,供CD8+ T细胞识别。MHC-I通过高尔基体传递到细胞表面,向CD8+ T细胞呈递肿瘤相关肽,CD8+ T细胞通过TCR识别抗原肽片段作为转化细胞上的肽-MHC-I复合物。随后,CD8+细胞被刺激进行克隆扩增并产生细胞因子,使细胞溶解效应物活性增强,并通过抗原分泌杀死肿瘤细胞。肿瘤细胞通过下调MHC-I来抑制HLA-I抗原的表达和功能,避免被CD8+ T细胞识别和破坏。诱导免疫反应
MHC-I分别通过与巨噬细胞和NK细胞表面的抑制性受体结合,保护肿瘤细胞免受巨噬细胞的吞噬和NK细胞的杀伤。在体外或体内,阻断MHC-I或抑制LILRB1可增强巨噬细胞对肿瘤细胞的吞噬作用,表达β2m的肿瘤细胞可阻止巨噬细胞对肿瘤细胞的吞噬作用,使肿瘤细胞得以逃避免疫反应。这表明MHC-I-LILRB1信号轴具有抗吞噬信号的功能。肿瘤细胞通过MHC-I模块表达逃脱NK细胞的杀伤,这在MHC-I结合蛋白一节中介绍过。CD24-Siglec-10轴的机制和功能
CD24-Siglec-10通路的机制
巨噬细胞表面的抑制性受体Siglec-10与癌细胞上的配体CD24结合,导致Siglec-10细胞质域的ITIM或ITIM样基序与Src家族激酶相互作用。然后,Src家族激酶磷酸化细胞质中的ITIM酪氨酸,从而招募蛋白质酪氨酸磷酸酶(PPPs),如SHP-1和SHP-2。SHP-1特异性结合到细胞内磷酸化的ITIM结构域,使其去磷酸化,导致细胞骨架重塑和吞噬抑制(图5d)。此外,SHP-1负向调控细胞内信号转导,包括细胞粘附分子、细胞外基质因子、激素、细胞因子和生长因子。因此,CD24与Siglec-10的相互作用抑制巨噬细胞的吞噬作用,促进肿瘤的免疫逃逸。通过基因编辑或抗体阻断肿瘤细胞CD24或巨噬细胞Siglec-10的表达,在体内可以增强巨噬细胞的吞噬能力,抑制肿瘤生长。此外,CD24还与T细胞、DC细胞、NK细胞等其他免疫细胞表面的Siglec-10结合,抑制其功能。这些机制都依赖于Siglec-10,它有一个ITIM或类似ITIM的基序。ITIM通过阻断TLR介导的炎症和激活以下细胞内信号通路在免疫抑制和肿瘤免疫逃逸中发挥作用。CD24-Siglec-10通路的功能
肿瘤细胞上高表达的CD24与巨噬细胞表面的Siglec-10相互作用抑制巨噬细胞的吞噬作用;因此,肿瘤细胞不能通过巨噬细胞的吞噬作用被清除。Siglec-10,像Siglec家族的其他成员一样,优先与肿瘤细胞中唾液酸化的CD24结合,CD24的唾液酸化有助于肿瘤细胞逃脱巨噬细胞的吞噬。肿瘤细胞上CD24与NK细胞上Siglec-10相互作用,有助于肿瘤细胞逃避NK细胞的杀伤作用,促进肿瘤免疫逃逸。当CD24与T细胞表面的Siglec-10相互作用时,通过抑制T细胞受体相关激酶如Lck和ZAP-70来阻断TCR的激活,从而促进T细胞的杀伤逃逸。CD24与B细胞表面的Siglec-10结合抑制BCR调控的信号转导,促进肿瘤逃逸。此外,CD24和Siglec-10之间的相互作用参与了复杂的胎盘免疫抑制反应。STC-1在吞噬作用中的机制
STC-1通过上调VEGF促进肿瘤血管生成和转移,这种方式依赖于癌细胞中PKCβII和ERK1/2通路的激活。STC-1已被证明是细胞内“吃我”信号抑制剂和未被重视的吞噬作用检查点。在机制上,STC-1与癌细胞中的“吃我”信号Calreticulin相互作用,取消APCs(包括巨噬细胞和DC)的膜性Calreticulin定向吞噬,从而削弱APCs向T细胞的抗原呈递,同时抑制癌细胞被巨噬细胞吞噬。肿瘤STC-1对于肿瘤自身抵抗肿瘤免疫至关重要。它通过在线粒体和ER中捕获Calreticulin抑制巨噬细胞功能,在肿瘤免疫逃避和免疫治疗耐药中发挥重要作用(图5e)。靶向STC-1及其与钙网蛋白的相互作用可能是使患者对癌症免疫治疗敏感的一种方法。用中和性抗STC -1单克隆抗体处理的卵巢癌细胞比对照细胞表现出更高的凋亡率。在人类肺癌的小鼠模型中,靶向STC-1表达的肿瘤细胞表现出有效的抗肿瘤作用。GD2在吞噬作用中的机制
作为一种唾液酸连接糖脂(一种唾液聚糖),GD2可以被唾液酸结合蛋白如Siglecs识别。GD2专门与Siglecs -7结合,而不是与人类的其他Siglecs结合。Siglec-7是一种含有细胞质ITIM结构域的免疫抑制分子,存在于人巨噬细胞和NK细胞中。Anti-GD2破坏GD2-Siglec-7相互作用,上调Calreticulin这一“吃我”信号,促进吞噬作用(图5f)。抗GD2与抗CD47在吞噬作用中具有协同作用。B6H12 (CD47抗体)和恩杂鲁胺 (GD2抗体)的联合使用显著增加了小胶质细胞对成神经细胞瘤细胞的吞噬作用,极大地增强了抗肿瘤反应,并延长了NSG小鼠同基因模型中的无肿瘤生存期。单核细胞负责这些抗GD2/抗CD47的协同反应。