心衰是一种复杂、多因素和异质性的综合征,患者的死亡和发病风险较高。既往研发的多种靶向治疗策略,可减弱导致心衰进展的病理生理途径,但以此为目标而研发的治疗策略并不总能使心衰患者获益。
鉴于心衰的病因复杂,因此具有广泛作用机制且针对多种途径的干预措施或可更有效地改善心衰预后。近日,Cardiovascular Research发表的一篇综述评估了当前心衰治疗策略的机制及其所针对的病理生理途径等。现将摘录部分要点,以飨读者。
传统来讲,根据左心室射血分数(LVEF),心衰可分为三种不同的表型:①射血分数降低的心衰(HFrEF),LVEF≤40%;②射血分数保留的心衰(HFpEF),LVEF≥50%有心衰症状和体征;③射血分数轻度降低的心衰(HFmrEF),LVEF 41%-49%。
不同表型,尤其是HFrEF和HFpEF具有不同的潜在病因和病理生理学。在HFrEF患者中,神经激素通路的过度激活是最常见的病理生理机制。相比之下,HFpEF具有多个重叠的病理生理结构,例如导致氧化应激的静脉淤血、titin低磷酸化使心肌细胞僵硬度增加,以及导致周围心肌心外膜脂肪组织沉积的脂联素和瘦素调节改变。
尽管目前的心衰试验取得了相当大的进展,揭示了与不同心衰表型相关的潜在机制,但HFpEF的病理生理学尚不完善。因此,大多数HFrEF治疗策略不能使HFpEF患者获益,这可能是因为潜在的治疗机制不同。因此,明确关键的病理生理学机制和途径仍然至关重要,针对不同机制和途径的药物或使不同亚组患者获益最大。
近几十年来,心衰研究的重点是明确左室收缩力降低及其可能的缓解途径。增加心肌收缩力是提高心脏性能的重点。因此,大部分初始研究集中于正性肌力药物的研发,以提高LVEF方面,其被认为可以提高长期生存率。
尽管通过刺激β1受体来增加细胞内钙浓度或肌节敏感性似乎可行,但这些药物仅可成功改善短期替代终点(如血流动力学),而无法改善长期死亡率,且这些药物试验常常因不良事件风险(如心肌缺血或室性心律失常)增加而提前终止。
Flolan国际随机试验首次证实了与安慰剂相比,多巴酚丁胺可增加死亡风险。尽管该项非随机事后分析仅显示,多巴酚丁胺或可增加死亡风险,但仍建议采用其他方法来刺激β1受体,以增加心脏收缩力。
磷酸二酯酶(PDE)抑制剂,如米力农、氨力农和依诺昔酮,可通过增加细胞内cAMP水平来增加细胞内钙浓度。尽管这些药物可通过不同的作用机制增加心脏收缩力,但其在心衰治疗中未产生临床获益。相反,与安慰剂相比,米力农可使全因死亡率增加28%。
尽管目前验证的大多数正性肌力药物对心衰具有中性或阴性影响,但地高辛是唯一一种可降低心衰住院风险的正性肌力药物。
《2018中国心力衰竭诊断和治疗指南》指出,正性肌力药物适用于低心排血量综合征,如伴症状性低血压(≤85 mmHg)或CO降低伴有循环淤血的患者,以缓解组织低灌注所致的症状,保证重要脏器的血流供应(Ⅱb,C)。
地高辛可通过阻断Na+-K+-ATP酶来发挥作用。除正性肌力药物外,地高辛还被认为是一种神经激素调节剂,具有良好的血流动力学作用。静注地高辛可降低心脏去甲肾上腺素,从而降低心衰患者的血管阻力。此外,其还能增强心脏迷走神经的张力并降低血浆肾素活性。尽管目前尚未明确其确切的自主神经作用机制,但既往正性肌力药物试验的阴性/中性结果提示,地高辛的神经激素抑制作用很可能是其降低心衰住院事件的原因。
DIG试验(8500例HFrEF患者)显示,与安慰剂相比,地高辛与心血管原因或心衰恶化住院率相对风险分别降低13%和28%相关,但两组患者在全因死亡率降低方面无明显差异。尽管地高辛组因心衰恶化所致的死亡率有降低趋势,但该组患者因其他原因所致的心血管死亡风险也有所增加(P=0.04)。鉴于既往试验中观察到的地高辛毒性,其促心律失常作用或抵消降低的心衰恶化死亡率获益。
对地高辛中毒的担忧以及更好的可替代药物,导致了地高辛在心衰治疗中应用率的下降。正在进行的试验(如DECISION试验)或将进一步明确地高辛在HFrEF患者中的疗效、安全性和最佳剂量。
尽管如此,地高辛仍是一种很好的替代药物,可用于无法耐受高剂量其他药物治疗的严重心衰患者,或尽管进行指南导向药物治疗(GDMT),但仍有症状的HFrEF患者。
对于HFrEF合并房颤患者,若心室率控制不佳,和/或尽管β受体阻滞剂耐受性最佳但仍有持续症状,或不能耐受β受体阻滞剂,建议考虑使用地高辛,包括慢性心衰、新发心衰或心衰住院等情况。
对于窦性心律的HFrEF患者,尽管使用了合适剂量的指南指导的药物治疗,仍有中、重度症状,建议考虑使用地高辛。
β受体阻滞剂是一种负性肌力药物,是高血压治疗和心绞痛预防的一线治疗策略。由于其可抑制心肌β1受体,减缓心率,降低心肌氧需求,从而有助于降低心绞痛的持续时间和频率。
鉴于β受体阻滞剂短暂的负性肌力作用有导致急性心衰患者快速失代偿的风险,因此最初这些药物在HFrEF患者中禁忌。然而,自1990年以来,多项里程碑意义的试验证实,HFrEF患者应用特定β受体阻滞剂的预后较好。
β受体阻滞剂的药理学获益可通过多种途径来发挥(图1)。阻断β受体可限制儿茶酚胺增加,抑制肾素释放,改变收缩力和变时性,并对心肌发挥抗心律失常和抗缺血作用。
目前已证实,可用于HFrEF治疗的心脏选择性β受体阻滞剂(如比索洛尔、卡维地洛和美托洛尔)均可降低死亡率。
建议血流动力学稳定的患者,在心衰诊断后(包括住院期间)尽快进行β受体阻滞剂治疗。临床医生不应等到出院后才开始给予稳定患者β受体阻滞剂治疗。NYHA IV级的症状性心衰患者,待病情稳定后给予β受体阻滞剂治疗。既往有心肌梗死且LVEF<40%的患者,均建议开始使用β受体阻滞剂。
血管紧张素Ⅱ是一种有效的内源性血管收缩剂,可增加外周阻力和交感神经刺激,从而升高血压。ACEI可靶向血管血管紧张素转换酶(ACE),从而抑制血管紧张素Ⅰ转化为具有生理活性的血管紧张素Ⅱ,而ARB则用于阻断血管紧张素Ⅱ与其受体的结合(图2)。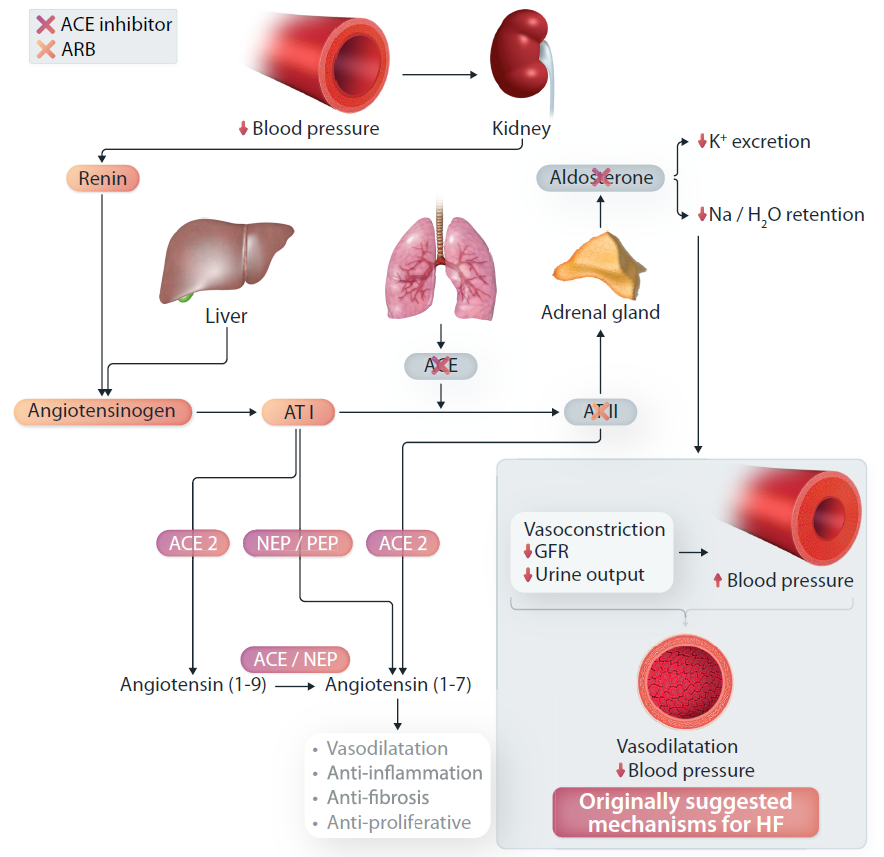 图2 ACEI和ARB的作用机制由于ACEI和ARB具有引起外周血管舒张和降低心脏前负荷和后负荷的能力,因此研发了主要的降压药物,主要针对肾素依赖性高血压。由于血管扩张和随后的血压降低,最初假设ACEI可使心衰患者获益。然而,由于其他更有效的血管扩张剂未能显示出心衰的任何死亡相关获益,因此在心衰患者中观察到的ACEI相关的获益可能是由于这类药物的多模式作用机制。事实上,随着心衰研究的进展,学者们逐渐认识到RAAS的有害上调是心衰的关键病理生理结构,并可通过引起液体潴留、外周动脉血管收缩、心室重塑、间质纤维化和心肌肥厚来促进其进展。通过阻断血管紧张素II并干扰心衰患者中RAAS的不适应过程,ACEI/ARB可增强钠尿,防止醛固酮释放,降低动脉和静脉压力、前/后负荷,并抑制心脏重塑。在具有里程碑意义的试验显示,ACEI/ARB可将心衰死亡率降低20%-30%。此外,CHARM-added试验还探究了在ACEI治疗基础上加用ARB的疗效,显示联合应用可降低复合心血管死亡和心衰住院风险,但肾功能恶化和高钾血症发生率也增加,提示HFrEF患者不能同时应用ACEI和ARB。尽管ACE可干扰RAAS,但其作用并不直接归因于血液中的肾素水平。其疗效或由于RAAS调节的ACE2/血管紧张素1-7通路上调所致,但这一点尚未明确。此外,系统研究提示,靶向多种病理生理学的机制可能是ACEI和ARB有利的药效学特征的原因。
图2 ACEI和ARB的作用机制由于ACEI和ARB具有引起外周血管舒张和降低心脏前负荷和后负荷的能力,因此研发了主要的降压药物,主要针对肾素依赖性高血压。由于血管扩张和随后的血压降低,最初假设ACEI可使心衰患者获益。然而,由于其他更有效的血管扩张剂未能显示出心衰的任何死亡相关获益,因此在心衰患者中观察到的ACEI相关的获益可能是由于这类药物的多模式作用机制。事实上,随着心衰研究的进展,学者们逐渐认识到RAAS的有害上调是心衰的关键病理生理结构,并可通过引起液体潴留、外周动脉血管收缩、心室重塑、间质纤维化和心肌肥厚来促进其进展。通过阻断血管紧张素II并干扰心衰患者中RAAS的不适应过程,ACEI/ARB可增强钠尿,防止醛固酮释放,降低动脉和静脉压力、前/后负荷,并抑制心脏重塑。在具有里程碑意义的试验显示,ACEI/ARB可将心衰死亡率降低20%-30%。此外,CHARM-added试验还探究了在ACEI治疗基础上加用ARB的疗效,显示联合应用可降低复合心血管死亡和心衰住院风险,但肾功能恶化和高钾血症发生率也增加,提示HFrEF患者不能同时应用ACEI和ARB。尽管ACE可干扰RAAS,但其作用并不直接归因于血液中的肾素水平。其疗效或由于RAAS调节的ACE2/血管紧张素1-7通路上调所致,但这一点尚未明确。此外,系统研究提示,靶向多种病理生理学的机制可能是ACEI和ARB有利的药效学特征的原因。既往试验表明,ACEI/ARB可使患者的死亡率获益,提示HFrEF患者除进行利尿剂、血管扩张剂、地高辛和β受体阻滞剂等药物外,还应进行ACEI/ARB治疗,表明多种机制或有助于减缓心衰进展。
血管紧张素受体脑啡肽酶抑制剂(ARNI)沙库巴曲缬沙坦进入体内会被分解为沙库巴曲和缬沙坦。沙库巴曲是一种前体药物,在肝脏中代谢,可通过酶切转化为活性形式LBQ657并通过抑制脑啡肽酶发挥作用。脑啡肽酶水解利钠肽(NP),包括心房利钠肽(ANP)、B型利钠肽(BNP)和C型利钠肽(CNP)。NP通过A型、B型和C型NP受体(NPR)发挥利尿、利钠、血管舒张和抗交感神经等作用。由于沙库巴曲可抑制脑啡肽酶的作用,故其间接增强了NP系统的上述过程。但是,脑啡肽酶的水解靶点不仅是NP,还包括其他几种血管活性肽如血管紧张素I、肾上腺髓质素、缓激肽、神经激肽A、神经肽Y、P物质和内皮素。因此,仅仅抑制脑啡肽酶可能引起反调节反应,从而抵消NP的预期作用,而同时应用缬沙坦抑制RAAS和沙库巴曲抑制脑啡肽酶的效果大于两者单独抑制的效果。ARNI调节两个基本的心衰通路可能会增加通过这种干预观察到的治疗获益。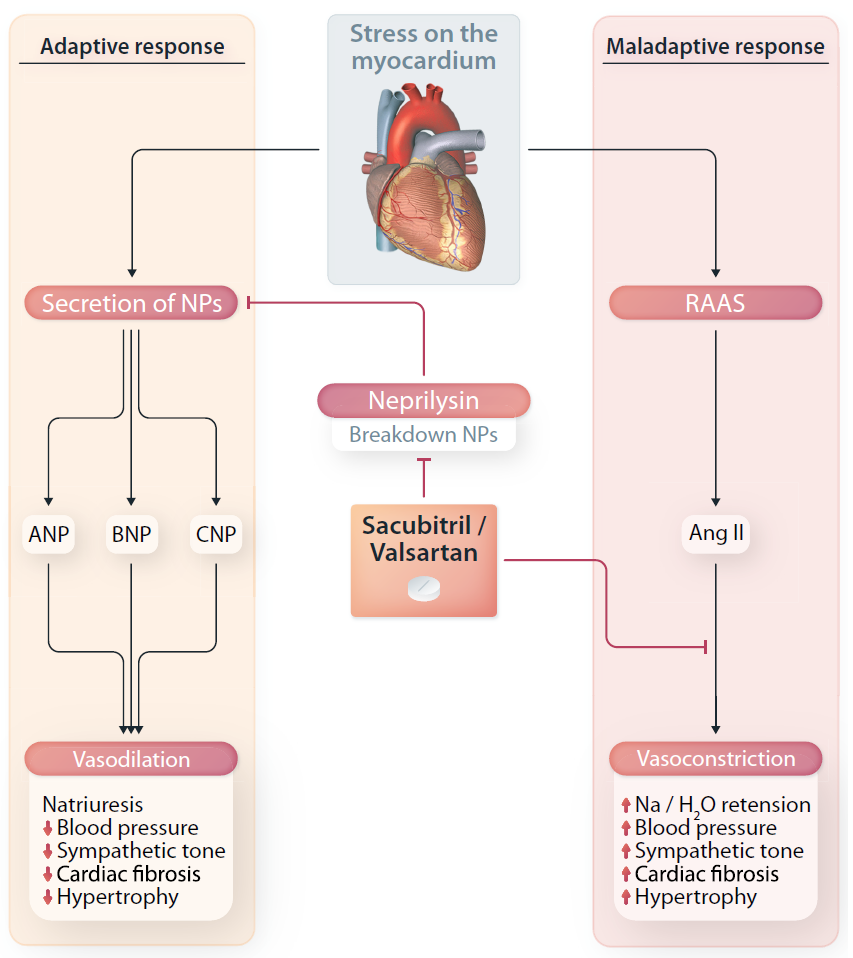 图3 ARNI的作用机制
图3 ARNI的作用机制
对于接受适当剂量ACEI或ARB治疗,仍有症状的HFrEF患者,建议使用ARNI代替ACEI/ARB。对于急性失代偿性HFrEF患者,建议在病情稳定后及出院前从ACEI/ARB转换为ARNI。建议新诊断的HFrEF住院患者将ARNI作为一线药物。
非选择性(如螺内酯)和选择性(如依普利酮)MRA可靶向多个上皮和非上皮位置的醛固酮受体。最初,醛固酮是作为一种强效利尿剂被开发的,20世纪50年代,关于醛固酮及其在人体中的关键作用的有限科学知识限制了MRA作为保钾利尿剂的应用。因此,这类药物最初被用作降压药物和利尿剂。经过数十年的研究,有学者指出,血管紧张素并非醛固酮分泌的主要来源,且醛固酮分泌过程中导致的血压升高主要是由于其对脉管系统和中枢神经系统的影响而发生。大量研究提示,醛固酮具有多种病理生理机制,MRA的作用机制从上皮部位扩展到非上皮部位。除最初的水钠潴留机制外,醛固酮还参与了促炎免疫表型,其或可导致氧化应激、心血管炎症、内皮功能障碍和心脏纤维化。因此,进行MRA治疗可减弱醛固酮介导的促炎状态,从而增加胶原合成和心室重塑。鉴于MRA可减少终末器官损伤,且具有利钠作用,因此HFrEF患者可联合应用MRAs、ACEI/ARBs和β受体阻滞剂,以增强RAAS阻断作用。尽管目前尚未在人类中评估MRA后心脏重塑,但既往试验的累积证据提示,MRA可使心衰患者在死亡率和发病率方面获益。最近,MRA在HFpEF患者中也取得了一定的结果。虽然TOPCAT多中心、随机双盲试验(纳入3445例LVEF>45%的症状性心衰患者)显示,与安慰剂相比,螺内酯未能改善主要终点(包括因心血管原因导致的死亡、心脏骤停、心衰再住院),但可改善次要终点心衰住院率;且螺内酯还可降低BNP升高患者的终点事件发生率。尽管这些发现对螺内酯在不同LVEF患者中发挥作用的潜在机制提出进一步疑问,但醛固酮活性的各种其他途径仍具有重要意义。其中,最值得注意的是,醛固酮对ACE2/Ang-(1-7)/Mas-R轴通路的作用。尽管尚无确凿的证据,但一些研究表明,Ang-(1–7)是醛固酮分泌的负调节剂。因此,探究MRA如何靶向该通路及其可能的临床获益仍是一个有趣的领域。建议急性心肌梗死、LVEF≤40%且有心衰症状或糖尿病的患者,给予MRA治疗,以降低死亡、心血管死亡以及心血管事件住院风险。
最初SGLT2抑制剂是作为降糖药物开发的,主要用于2型糖尿病治疗。SGLT2在近曲小管中表达,可介导约90%的葡萄糖重吸收。SGLT2抑制剂通过阻断SGLT2起作用,使尿液排出多余的葡萄糖,从而达到降低血糖的目的。因此,SGLT2抑制会导致糖尿,且不会干扰内源性胰岛素。SGLT2抑制剂早期心血管试验结果表明,在心血管疾病高危的T2DM患者中,心衰住院风险降低30%-35%。因此,其他更有效的降压治疗未能降低T2DM患者的心血管风险,提示SGLT2抑制剂具有独立于降糖能力的心脏保护作用。尽管SGLT2抑制剂可使整个射血分数范围内的心衰获益,但SGLT2抑制剂可使生存获益的确切机制尚未完全确定,提示SGLT2抑制剂可同时靶向多个通路,且被认为与心衰相关的多个器官系统具有有利影响(图4)。此外,SGLT2抑制剂的一个主要获益被认为与肾脏有关,其可抑制近端小管对钠的重吸收,从而促进渗透性利尿,其被认为是降压治疗的关键。通过降压治疗和对抗液体潴留,这些药物被建议用来降低心脏前负荷和后负荷,从而改善心室-动脉耦合。此外,也有研究提示,SGLT2抑制剂可通过减少潜在全身炎症来降低氧化应激,但这在心衰治疗中的确切机制尚未完全明确。可同时靶向多种途径的SGLT2抑制剂多模式机制尚需进一步研究证实。尽管目前SGLT2抑制剂正在多疾病过程中进行广泛研究,但其作用机制仍然未知。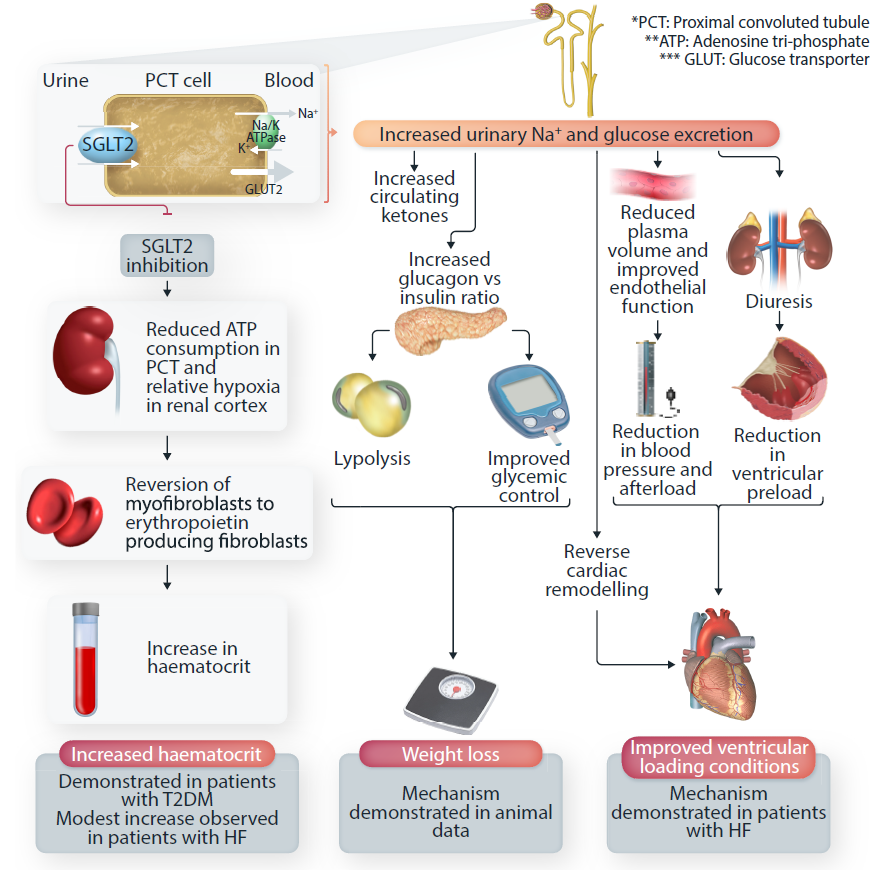
图4 SGLT2抑制剂的作用机制
建议伴或不伴2型糖尿病的HFrEF患者使用SGLT2抑制剂,例如达格列净或恩格列净,以改善症状和生活质量,降低心衰住院和/或心血管死亡风险。建议2型糖尿病合并动脉粥样硬化性心血管疾病(ASCVD)患者使用SGLT2抑制剂,例如恩格列净、卡格列净或达格列净,以降低心衰住院和死亡风险。建议50岁以上、伴其他ASCVD危险因素的2型糖尿病患者,使用SGLT2抑制剂,例如达格列净,以降低心衰住院风险。建议伴或不伴2型糖尿病的蛋白尿性肾脏疾病患者,使用SGLT2抑制剂,例如卡格列净或达格列净,以降低心衰住院和肾脏病进展风险。
流行病学证据表明,心率增加与心血管死亡之间密切相关。由于每个心动周期的长度缩短,心率升高会增加心肌的氧需求量,从而缩短舒张灌注时间。因此,伊伐布雷定首先被研究为抗心绞痛药物。因为它可降低心率,且不影响心肌收缩力、血压、心内传导或心室复极时间。伊伐布雷定是一种可降低心率的药物,适用于静息心率为70 bpm的窦性心律患者,可通过选择性和特异性抑制心脏起搏If电流,起到降低心率的作用。该通道阻滞可导致钠钾内向电流的抑制,延长舒张期去极化。因此,窦房结放电的速率减缓可导致心率降低,但不会对其他心脏参数参数影响。SHIFT试验显示,与安慰剂相比,伊伐布雷定可降低心衰住院风险(HR=0.74;95%CI:0.66-0.83;P<0.001)和心衰死亡率(HR=0.74;95%CI:0.58-0.94;P=0.01)。尽管β受体阻滞剂对窦房结有直接影响,但其所致平均心率降幅(可达12 bpm)更大。尽管调节心率是可能减轻不良心衰事件的途径之一,但β受体阻滞剂的优势或存在与其改变多种机制途径的能力中。建议仅在静息心率≥70 bpm的HFrEF患者中,进行β受体阻滞剂最大剂量治疗后,才开始伊伐布雷定治疗。
肼屈嗪和硝酸异山梨酯(ISDN)均具有舒张血管的作用,有助于降低前负荷和后负荷。肼屈嗪是一种动脉血管扩张剂,可通过直接放松血管平滑肌来降低外周血管阻力。就单药治疗而言,由于强效的血管舒张作用,其一直是高血压危象和妊娠高血压患者的长期治疗药物。尽管其诱导血管舒张的确切机制尚未明确,但有人认为可能是由于血管平滑肌中的Ca²⁺平衡改变或通过交感神经末梢释放的化合物作用所致。除此之外,肼屈嗪还具有抗氧化作用,有助于防止NO降解。ISDN是NO供体,可激活血管平滑肌中的可溶性鸟苷酸环化酶,随后增加cGMP,从而引起血管舒张并降低血管阻力,可用于心绞痛治疗。肼屈嗪和硝酸异山梨酯联合治疗有助于维持血管扩张,增加NO的生物利用度,从而维持血管张力和细胞氧化还原的平衡。对于因高钾血症、肾功能不全或其他禁忌证不能耐受ACEI、ARB或ARNI治疗的HFrEF患者,建议考虑使用肼屈嗪/硝酸异山梨酯治疗,包括慢性心衰、新发心衰和心衰住院三类患者。
由于环磷酸鸟苷(cGMP)在介导血管和心脏舒张中的关键作用,一氧化氮(NO)-可溶性鸟苷酸环化酶(sGC)-cGMP信号传导通路被认为在心衰病理生理学中具有至关重要的作用。在心衰中,NO或sGC的生物利用度较低,导致cGMP缺乏,从而使氧化应激持续存在,进而刺激自噬、细胞凋亡、心脏纤维化和不良心脏重塑。为此,在心衰中探究了几种可通过硝酸盐增加NO可用性或通过PDEs来降低cGMP降解,调节NO-cGMP途径的药物。然而,NO的半衰期较低,NO对PDE的抑制较小,从而导致这些药物在心衰中的临床应用有限。因此,sGC激动剂被认为是直接刺激cGMP产生的下一个最佳治疗靶点。利奥西呱(riociguat)是一种sGC刺激剂,可靶向调节NO-SGC-cGMP的途径。最初其被开发用于肺动脉高压治疗,但在HFrEF患者中同样表现出良好的安全性,且可改善生活质量和心脏指数。然而,较短的半衰期限制了其在心衰中的应用。维立西呱(vericiguat)可与NO 协同作用,即使在低NO的条件下也能产生 cGMP,从而恢复了心衰中受损的NO-sGC-cGMP通路,减少氧化应激,改善血管张力和心肌功能障碍,且能改善不良心室重塑。VICTORIA全球试验显示,与安慰剂组相比,维立西呱组患者的主要终点(心血管死亡或首次心衰住院的复合终点)发生率显著降低10%(35.5% vs. 38.5%,HR:0.90;P = 0.019)。sGC刺激剂针对一种独特的机制,代表心衰患者的一种新型治疗选择。更为重要的是,维立西呱靶向独立于ACEI/ARBs(RAAS)和β受体阻滞剂(交感神经刺激)的途径(NO-sGC-cGMP),从而补充了当前心衰药物治疗。对于过去6个月内有恶化症状或心衰住院的HFrEF患者,建议在最佳心衰治疗基础上加用维立西呱,以降低心衰住院风险。
Omecamtiv mecarbil是一种直接心肌肌球蛋白激动剂,也是一种新型的正性肌力药物,可以增加心肌收缩力而不影响心肌细胞钙稳态,不增加心肌耗氧量以及dP/dt max,并且可增加收缩期射血时间。作为一种选择性心肌肌球蛋白激动剂,Omecamtiv mecarbil对心肌细胞内钙的量级没有影响,后者是既往正性肌力药物中室性心律失常发生率和死亡率增加的关键驱动因素。GALACTIC-HF试验显示,严重心衰患者可在Omecamtiv mecarbil治疗中获益;且终点事件与基线LVEF相关,LVEF越低,患者获益越大。
[1]Muhammad Shahzeb Khan, Izza Shahid, Stephen J Greene, Robert J Mentz, Adam D DeVore, Javed Butler, Mechanisms of current therapeutic strategies for heart failure: more questions than answers?. Cardiovascular Research. 2022; 118(18):3467–3481.[2]中华医学会心血管病学分会心力衰竭学组, 中国医师协会心力衰竭专业委员会中华心血管病杂志编辑委员会. 中国心力衰竭诊断和治疗指南2018. 中华心血管病杂志, 2018, 46(10): 760-789.[3]Michael McDonald, Sean Virani, Michael Chan, et al. CCS/CHFS Heart Failure Guidelines Update: Defining a New Pharmacologic Standard of Care for Heart Failure With Reduced Ejection Fraction. Can J Cardiol.2021 Apr;37(4):531-546.