关键词:文献精读;重症肌无力;FcRn
导言:
“领读者”专辑立足重症肌无力(MG)诊疗以及新生儿Fc受体(FcRn)靶点前沿,筛选国内外最新发表的文献,邀请MG领域专家解读分享和点评要点,传播最新学术进展,提高国内相关专病医生对MG前沿学术进展以及FcRn靶点的理解。
编译 丨 谢琰臣 博士(Healsan)/ Dr. Qi
点评 丨 王玉鸽 博士(中山大学附属第三医院神经科)
编辑 丨 Sophia Meng 博士(乔治华盛顿大学医院病理科)
1,利妥昔单抗治疗新发全身性重症肌无力的疗效和安全性评估:
RINOMAX随机临床试验
原文 丨 Fredrik Piehl, et al.(瑞典卡罗琳斯卡大学医院)

重症肌无力(MG)是一种典型的自身抗体介导的神经免疫性疾病,在瑞典的患病率为24.8/10万人。
大多数MG血清中能检出乙酰胆碱受体(AChR)抗体,而针对肌肉特异性激酶(MuSK)或脂蛋白受体相关蛋白4的抗体则更少见,还有一部分人缺乏针对已知抗原靶点的抗体(血清阴性MG)。
利妥昔单抗是一种被批准用于B细胞淋巴瘤、类风湿性关节炎和血管炎的嵌合抗CD20单克隆抗体,可消除未成熟、幼稚和记忆B细胞,但不能消除浆细胞。
因此,至少理论上利妥昔单抗在发病早期开始使用,可能会阻碍疾病相关浆细胞库的积累。
在一项观察性研究中,来自瑞典卡罗琳斯卡大学医院的Fredrik Piehl团队发现利妥昔单抗治疗全身性重症肌无力的有效性。
在此基础上,2022年9月,Fredrik Piehl团队在JAMA Neurology杂志发表了一篇题为“Efficacy and Safety of Rituximab for New-Onset Generalized Myasthenia
Gravis:The RINOMAX Randomized Clinical Trial”的文章,这是一项多中心、安慰剂对照双盲随机试验,以比较利妥昔单抗治疗MG的疗效和安全性。

研究设计
PICOS:
P:受试者年龄大于18岁,全身症状发生时间不超过12个月,重症肌无力定量(QMG)评分为6分或更高。
排除标准包括:眼肌型MG、合并胸腺瘤、既往胸腺切除术和既往非皮质类固醇免疫抑制剂或高剂量皮质类固醇治疗。
I/C:参与者按1:1随机分配,不分层,单次静脉输注500 mg利妥昔单抗或匹配安慰剂。
O:观察指标:16周时的最小临床表现定义为QMG评分为4或以下。
S:研究设计:一项多中心、安慰剂对照双盲随机试验。
研究设计如下图所示,25人被随机分配到利妥昔单抗组、22人随机分配到安慰剂组。
🔺 图1. 研究设计流程图
在第16周的观察节点,利妥昔单抗组和安慰剂组分别有24人中的17人(71%)和21人中的6人(29%)达到了主要结局。
在第24、36和48周依然是利妥昔单抗组有更高比例达到最小临床表现(图2)。
从Kaplan-Meier曲线中可以观察到从第9周到第24周,安慰剂组更需要补救治疗措施。
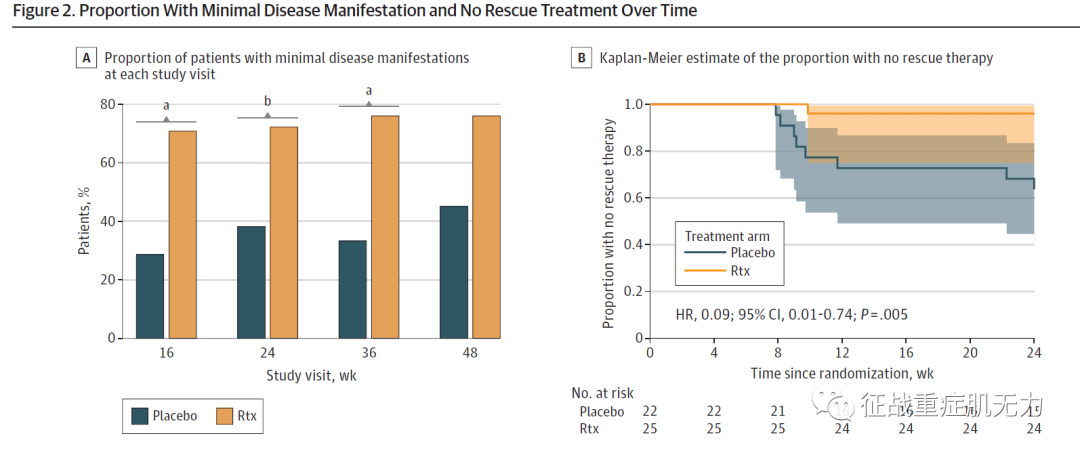
🔺 图2. 在每个研究观察节点治疗组和对照组患最小症状的比例(A)以及没有接受抢救治疗的Kaplan-Meier比例评估(B)。随后,作者拟合了2个逻辑回归模型,针对年龄、早发性疾病等进行调整,同时进行了一项事后分析,排除了年龄小于40岁且有合并症但结果几乎没有变化的患者。
预定义的三级终点(补救治疗)在各组之间没有差异,但在第16周时在利妥昔单抗组和安慰剂组分别有3名和7名患者,而在第24周时分别有2名和9名患者需要补救治疗。
此外,安慰剂组有3名患者出现需要住院的MG恶化(1名需要有创通气),而利妥昔单抗组则没有。
在第24周评估的利妥昔单抗和安慰剂之间的AChR抗体滴度没有显着差异。
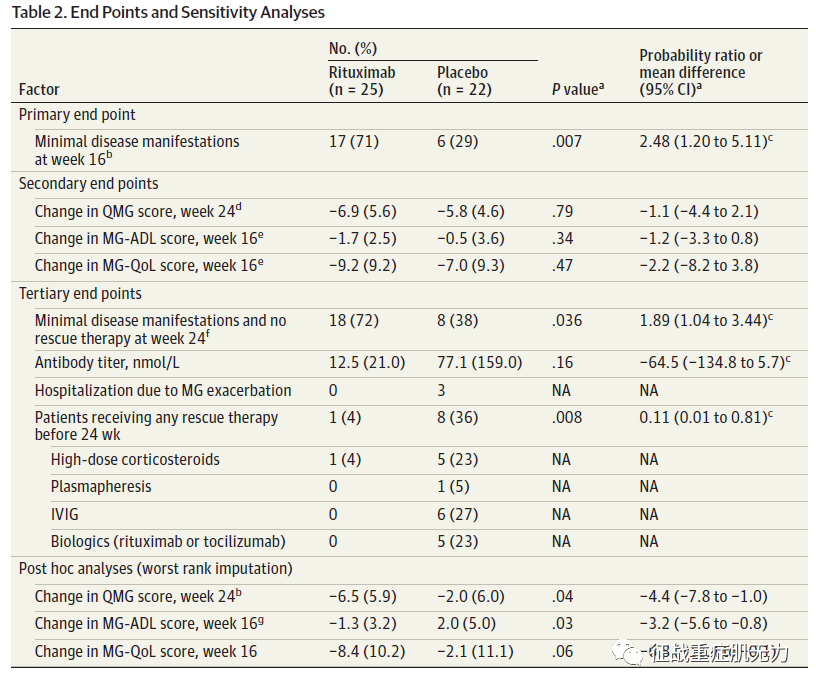
🔺 表2. 终点和敏感性分析
与安慰剂相比,利妥昔单抗组的不良事件数量更多(81 vs. 44),利妥昔单抗组和安慰剂组的严重不良事件分别为6例 vs. 4例(下表3)。
一名MG患者在基线后4周经历了致命的心脏事件,该患者先前存在但被评估为稳定的缺血性心脏病。安慰剂组的两名患者经历了危及生命的事件,但没有后遗症而康复(1名在MG恶化的情况下患有心肌梗塞并伴有心脏骤停,1名在MG危象期间患有细菌性败血症)。利妥昔单抗组和安慰剂组分别报告了3人和1人的轻度输液反应。
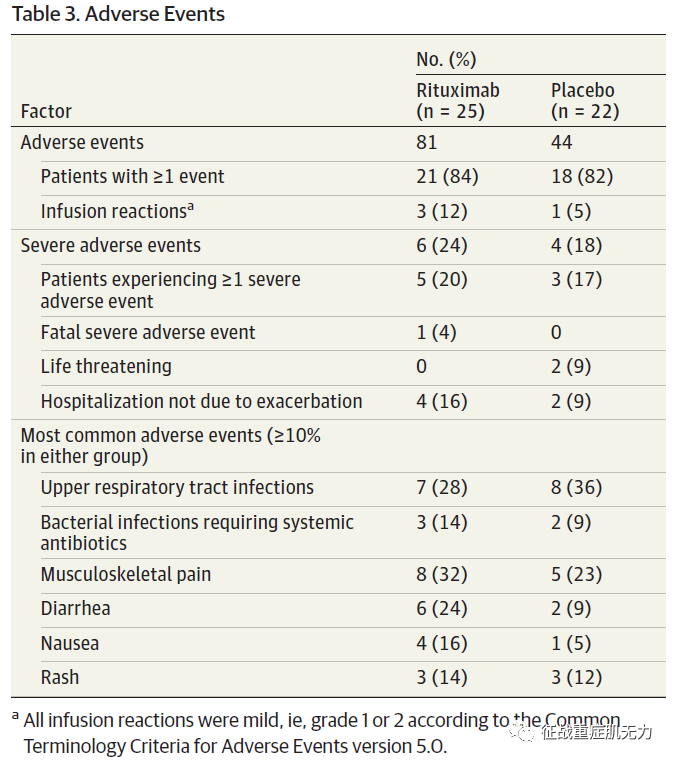
🔺 表3. 不良事件
这项研究显示,接受低剂量利妥昔单抗方案的患者组达到最小临床表现的比例远高于安慰剂组;同时,安慰剂组会更频繁地使用抢救治疗比如因MG恶化而需要机械通气的肌无力危象等,表明针对全身性 MG、利妥昔单抗是潜在的治疗药物。
【1】 Piehl F, et al. Efficacy and Safety of Rituximab for New-Onset Generalized Myasthenia Gravis: The RINOMAX Randomized Clinical Trial. JAMA Neurol. 2022 Nov 1;79(11):1105-1112. doi: 10.1001/jamaneurol.2022.2887. PMID: 36121672; PMCID: PMC9486640.点评
疾病相关抗体分泌细胞的产生和自身抗体的分泌是MG发病机制中的重要环节。本研究设计了一项多中心、安慰剂对照双肓随机试验,评估和比较了利妥昔单抗(RTX)治疗新发gMG的疗效和安全性。结果显示,相较于安慰剂组,低剂量RTX治疗组能显著提高gMG达到最小临床表现的比例,能减少MG恶化的风险。由此,本研究得到结论:RTX是潜在的治疗新发gMG的药物。目前,RTX作为MG适应征外靶向B细胞的生物制剂,已临床用于对激素和免疫抑制剂疗效差的难治性MG。基于此研究,提示我们需要更多的大样本RCT研究,设计不同的分层试验,观察不同MG亚组下RTX治疗新发性MG,评估其对MG急性期及长期的疗效和预后,获得RTX治疗下的强证据用药方案。最后,利用RTX治疗新发性MG,也将有利于探索MG的发病机制。原文丨E. Sally Ward, et al.(美国德克萨斯农工大学健康科学中心)当前基于抗体治疗的疗效在很大程度上取决于体内适当部位治疗性抗体水平的稳态调节。例如,为了使治疗性抗体在治疗癌症中发挥最大功效,有必要在肿瘤部位长时间维持足够的治疗抗体水平。
相比之下,对于抗体介导的自身免疫性疾病,如重症肌无力或特发性血小板减少性紫癜,致病性抗体水平过高,就需要降低抗体水平。
那么控制抗体水平的分子机制是什么?如何利用已有知识来调整治疗性或内源性抗体的水平和分布?
FcRn是MHC I类分子相关受体,作为重链-β2-微球蛋白异二聚体与 IgG类抗体相互作用(图1),可以调节IgG抗体在全身的动态行为如分布和运输。因此,靶向FcRn不失为一种有潜力的新型抗体平台。
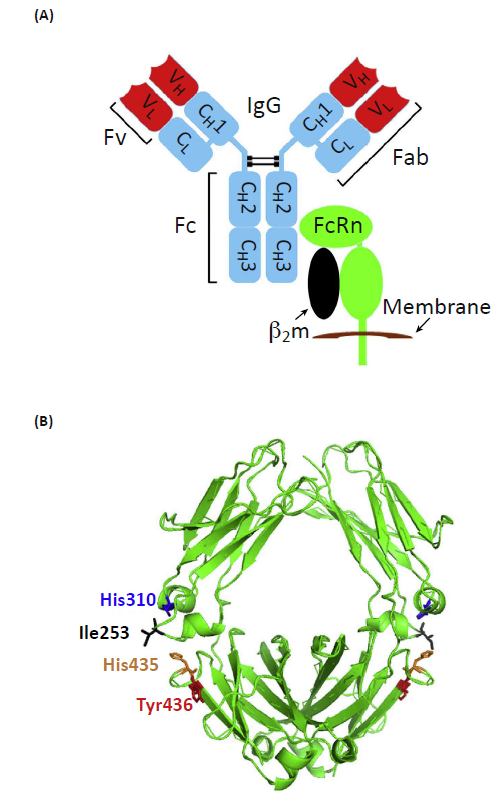
🔺图1. IgG-FcRn相互作用示意图。
2018年8月,来自美国德克萨斯农工大学健康科学中心的E. Sally Ward 等在Trends Pharmacol Sci杂志上发表了一篇题为“Targeting FcRn to Generate Antibody-Based Therapeutics”的综述,针对以上问题展开了描述和讨论。

了解FcRn的亚细胞运输行为对于了解维持IgG稳态的机制非常重要,此外还有助于深入改良在人体中能够起到治疗作用的工程抗体设计。用GFP标记的FcRn转染后内皮细胞的活细胞成像(跟踪FcRn活细胞)表明,FcRn-IgG复合物主要通过液相胞饮作用内化。当细胞内IgG水平增加时,所有FcRn分子都处于结合状态,过量的游离抗体在溶酶体中降解(图2)。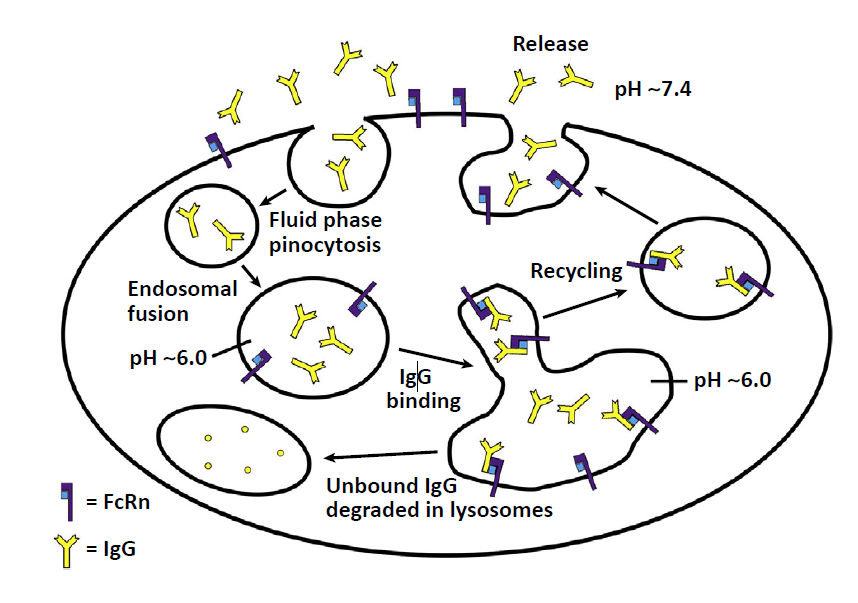
🔺 图2. FcRn作为IgG内稳态物的活性模型。
需要注意的是,免疫复合物(IC)向溶酶体的传递对宿主防御有几个重要的影响。其次,这可能会阻止与抗体结合的病原体通过上皮屏障的转胞吞作用。第三,对于造血细胞,抗原呈递细胞中FcgR对多聚体IC的内化之后是“移交”到FcRn,由于细胞外pH值接近中性,FcRn通常不参与摄取,在早期内体中导致抗原递送到交叉呈递(涉及MHC I类)和MHC II类呈递途径均可刺激T细胞介导的免疫。单克隆抗体广泛用于中和毒素或炎症分子,如细胞因子。然而,这些抗体通常与一个或两个靶分子结合(由于每个抗体分子存在两个抗原结合位点),除非重复其靶点上的结合位点,否则这些试剂的递送不会导致免疫复合物形成。由此,这些抗体可能会产生作为其靶标载体的不良影响,从而延长而不是减少这些不需要的分子的持久性。这种效应会降低被递送以中和此类有害分子的抗体的功效。此外,在某些情况下,抗原与抗体的结合可以增加抗体的清除率,从而导致有效剂量降低,虽然其途径尚不完全清楚,但可以通过抗体进入后靶抗原的清除行为来确定-抗原复合物进入细胞。酸转换抗体在接近中性的 pH 值比在酸性 pH 值以更高的亲和力与其靶标结合。这些抗体在内化到细胞后从酸性内体中的抗原解离。酸转换的结果是,当抗体被FcRn回收时,抗原被递送到溶酶体并被降解。因此,每种抗体都避免了溶酶体降解,并且可以多次加载抗原,其优点是此类抗体的反复使用需要相对于抗原加载的亚化学计量剂量。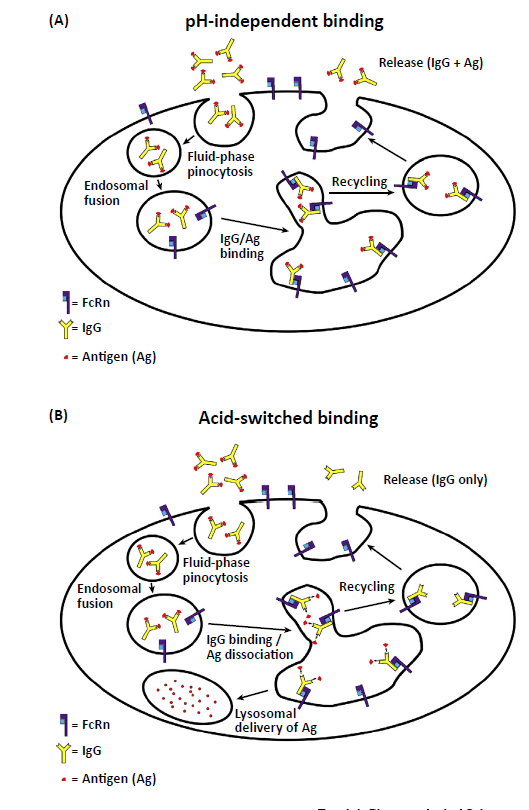
除了“酸转换抗体”外,还有一种替代方法“钙转换抗体”,该方法利用了相对于细胞外空间的内体中显着较低水平的钙。具体而言,可以对Ca2+转换抗体进行工程改造,使其在相对于微摩尔浓度的毫摩尔Ca2+浓度下以更高的亲和力与其抗原结合。迄今为止,非人类灵长类动物研究和几种基于FcRn的抑制剂的临床试验结果表明,它们可诱导健康志愿者内源性IgG水平显着且持续下降,并且对自身免疫性疾病重症肌无力也有有益作用。尽管此类FcRn抑制剂在临床治疗自身免疫方面具有相当大的潜力,但它们会导致IgG水平的整体降低。这促使开发一种方法来选择性地消耗特定结合特异性的抗体,同时不影响不同特异性抗体的清除,使用称为Seldegs的工程化抗原-Fc融合体(用于抗原特异性抗体的选择性降解)。Seldegs可以与表面暴露的FcRn结合并被其迅速内化,然后进入溶酶体途径。因此,与抗原-Fc融合蛋白结合的抗体被选入这一降解途径,导致它们的破坏。迄今为止,Seldegs已被证明可特异性清除抗原特异性抗体,而不会影响无关特异性抗体的水平。Seldegs的作用机制只需要靶向FcRn分子的一个子集;因此,不降低总IgG水平的相对低剂量足以达到疗效。这与以更高剂量使用的FcRn抑制剂形成对比,以实现与体内功能性FcRn的定量结合,导致与内源性IgG的有效竞争。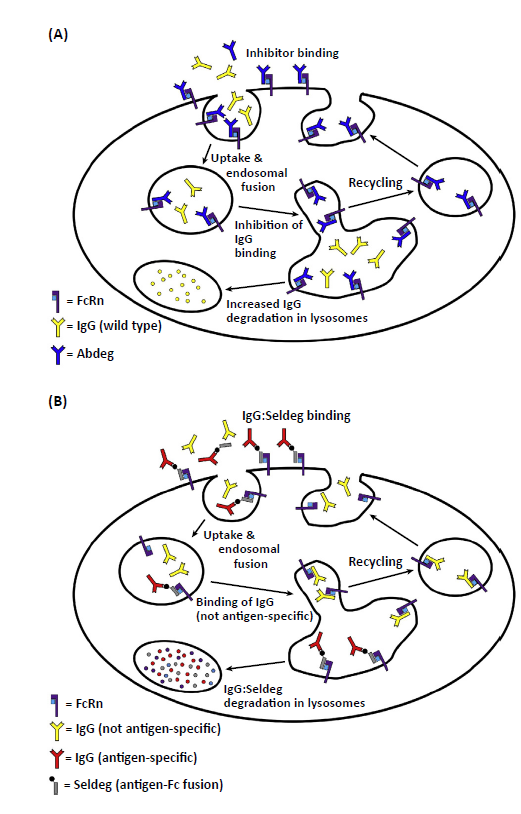
将FcRn确定为调节IgG药代动力学的主要参与者已促使数个抗体工程产生新的基于抗体的平台。在此基础上,已实施半衰期延长技术以产生更长寿命的抗体。随着体内持久性延长的抗体的开发,随后出现了抑制/阻断FcRn的补救功能的技术,从而降低了内源性IgG的水平。最近,通过酸转换和/或清除方法开发了加速清除有害抗原和抗原特异性抗体的策略。正在进行的实施其中几种策略的临床试验为基于FcRn的疗法提供了一个激动人心的时代。例如FcRn-IgG和抗原-IgG相互作用的分子性质如何与全身水平的IgG或抗原的动态行为相关联?此外,不同FcRn抑制剂的FcRn相互作用特性如何影响其在不同疾病环境中的治疗效果?使用分子和细胞方法的组合来解决这些问题预计将导致对这些问题的重要洞察力,进而可能导致改进人类疾病的治疗方法。【1】 Ward ES, Ober RJ. Targeting FcRn to Generate Antibody-Based Therapeutics. Trends Pharmacol Sci. 2018 Oct;39(10):892-904. doi: 10.1016/j.tips.2018.07.007. Epub 2018 Aug 22. PMID: 30143244; PMCID: PMC6169532.
当下,基于FcRn的生物学特性来开发抗体药物被认为极具治疗潜力。本研究主要通过阐释FcRn的亚细胞运输过程以及维持机体内IgG稳态的机制,基于此,提出潜在的疾病治疗性工程抗体设计策略。比如抑制/阻断FcRn的补救功能的技术,可降低内源性IgG的水平。如通过酸转换和/或清除方法,开发了加速清除有害抗原和抗原特异性抗体的策略。在自身免疫性疾病治疗领域,通过开发与FcRn结合的药物,阻断FcRn与致病IgG抗体结合,可降低IgG抗体表达水平,进而达到治疗疾病的目的。就重症肌无力而言,目前全球首款FcRn拮抗剂efgartigimod国内新药上市申请获受理,批准用于治疗全身型重症肌无力。通过进一步对FcRn的生物学功能的研究,将基于靶向FcRn的新型抗体治疗平台,研发出更多的新型治疗药物,将使自身免疫性疾病药物治疗迎新突破,为重症肌无力患者带来疗效更好、安全性更佳的治疗选择。3,长期使用他克莫司治疗重症肌无力的缓解和复发:一项中国队列的回顾性横断面研究原文 丨 Zhuajin Bi, et al.(华中科技大学同济医学院同济医院)
重症肌无力(MG) 是一种免疫介导的神经肌肉疾病,由循环抗体引起,包括抗乙酰胆碱受体 (AChR)、抗肌肉特异性激酶(MuSK) 抗体和低密度脂蛋白受体相关蛋白 4 (LRP4) 抗体。长期治疗计划应包括免疫治疗。糖皮质激素(类固醇)是控制 MG 症状的主要治疗选择;虽然有效,但长期使用类固醇通常会导致相当大的副作用。他克莫司是一种钙调神经磷酸酶抑制剂,被广泛用作一种有效的免疫抑制剂来改善 MG 患者的症状,尤其是在亚洲人群当中。一些研究集中在加用他克莫司后达到缓解所需的时间,以及与他克莫司的初始作用时间相关的因素和停用泼尼松的可能性。此外,一旦 MG 症状得到有效控制,他克莫司应逐渐减量以避免不必要的费用和不良事件。但快速减少他克莫司的剂量可能导致肌无力复发。因此,了解他克莫司减量后初始恶化的频率和预测因素至关重要。2022年9月,华中科技大学同济医学院同济医院卜碧涛团队在Ther
Adv Chronic Dis杂志上发表了一篇题为“Remission and relapses of myasthenia gravis on long-term tacrolimus: a retrospective cross-sectional study of a
Chinese cohort”的文章,对接受强的松和他克莫司治疗的 MG 患者的结果进行了回顾性队列分析,以确定预测 MG 患者达到缓解所需的时间、强的松停药频率、他克莫司减量相关的复发和治疗结果的因素。
P/I/C:对在同济医院接受强的松和他克莫司治疗且未出现严重不良事件的256名患者纳入研究。O:观察指标:缓解时间、泼尼松停药、他克莫司减量相关复发和治疗结果。
主要研究结果
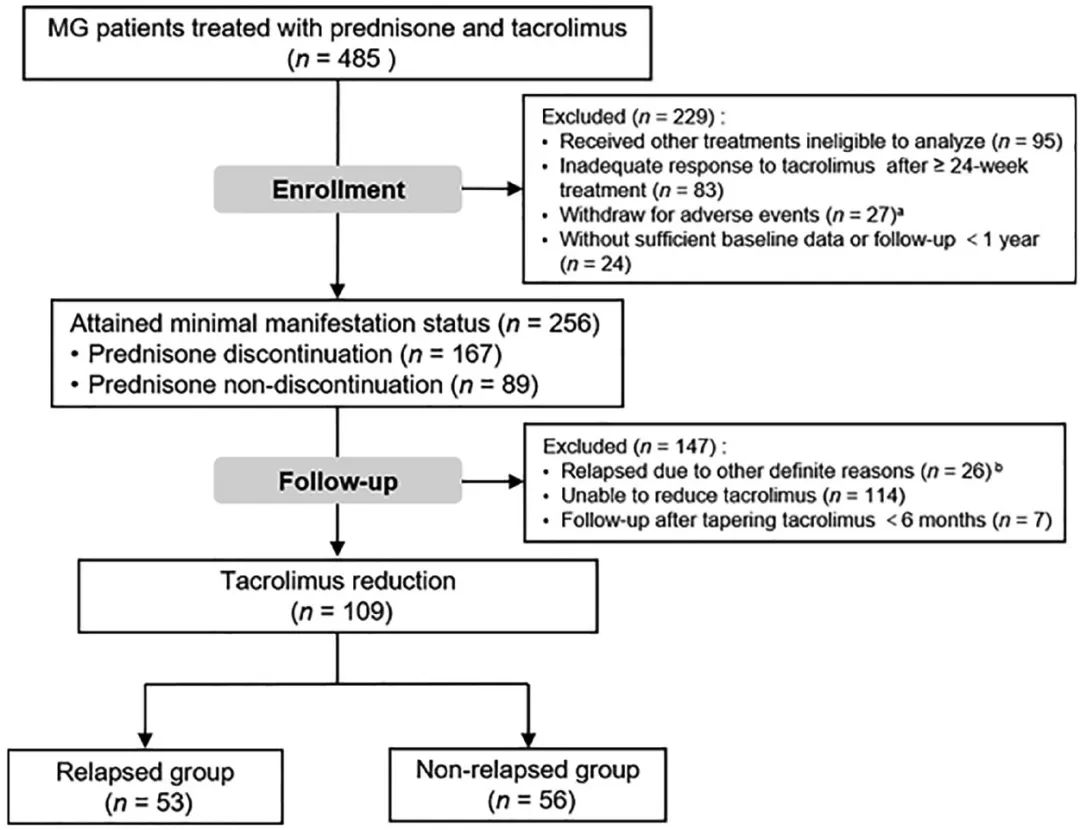
图1,研究流程图
最终共有256 名患者参与这项研究,中位随访时间为 2.9 年,正文表1总结了这些参与者的基线临床数据。患者在平均2.1±1.4个月后达到缓解,QMG评分平均降低8.0±4.3。在多元线性回归分析中,发现女性、QMG评分和他克莫司浓度是缓解时间的独立预测因子(表2)。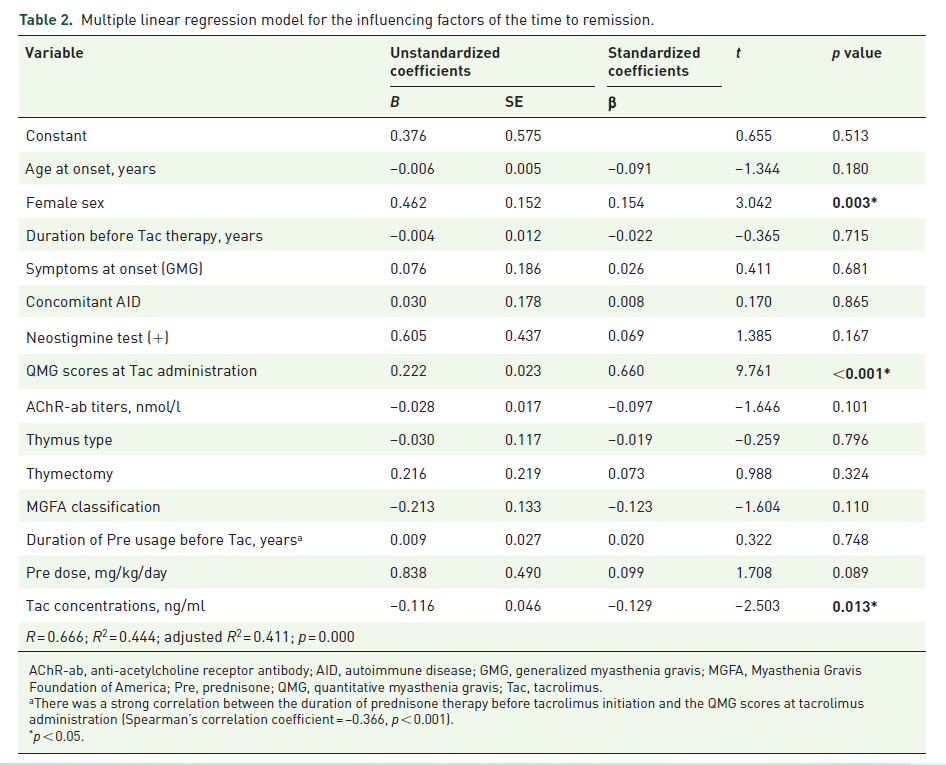
通过Spearman检验,他克莫司浓度与QMG评分降低相关。在他克莫司给药之前,所有患者都服用泼尼松的中位(IQR)持续时间为0.3年。添加他克莫司后,泼尼松剂量显着下降,下降速度为0.97 mg/月,从基线时的平均22.87±12.14
mg/天降至最后一次就诊时的3.07±5.08 mg/天。在平均时间为1.24±1.10年后,167名患者(65.2%)最终停用了泼尼松(图2)。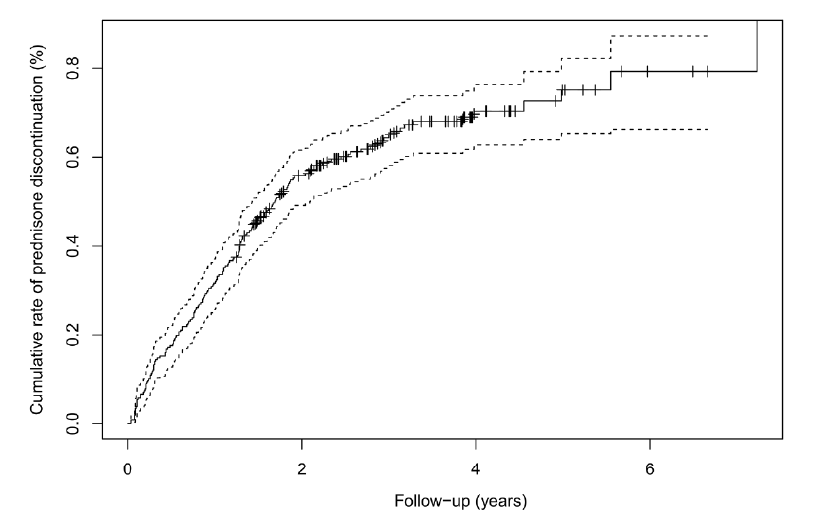
随后,作者将256例患者进一步分为两组:泼尼松停药组(n=167)和非停药组(n=88)。使用单变量逻辑回归分析发现,发病年龄、初始症状、AChR-ab滴度、他克莫司给药年龄和随访时间等与泼尼松停药有关。多变量逻辑回归分析表明伴随的额外的自身免疫疾病(AID)和AChR-Ab 水平是泼尼松停药的独立预测因子(表3)。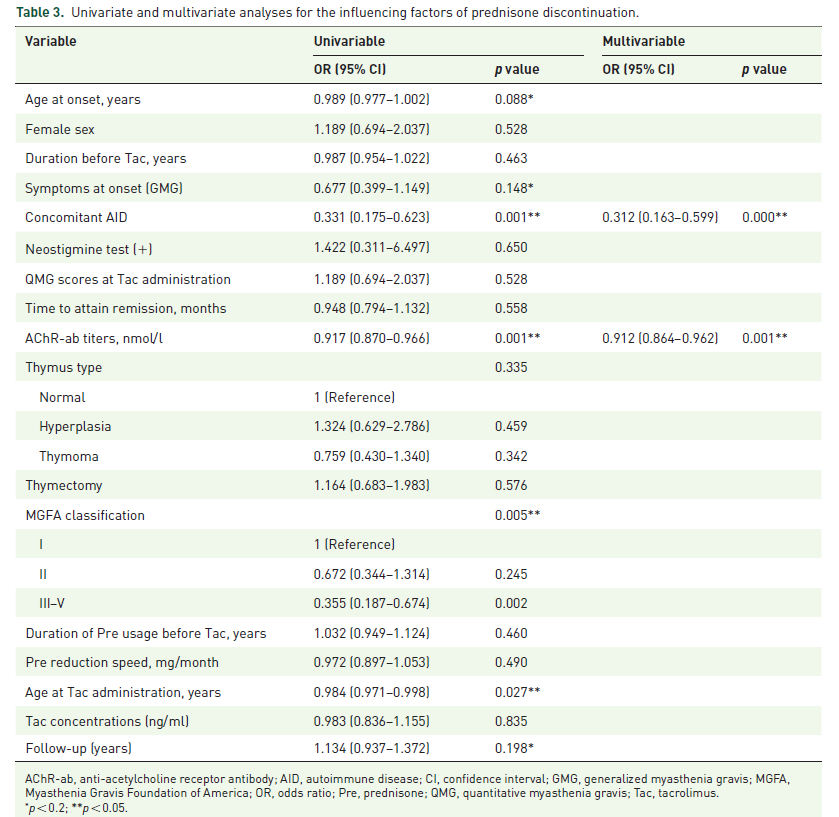
所有256名患者均接受每日2-3mg的他克莫司,其中有109名(42.5%)接受了减量治疗,这些患者分为两组:复发性MG组(n=53)和非复发性MG组(n=56)。在他克莫司减量前,所有患者均无MG症状或体征。与基线相比,53名MG复发患者的QMG评分在复发时显着增加,平均QMG评分为9.6±5.6分。复发患者从他克莫司减量到复发的平均滞后时间为2.1±1.6个月。单变量结果显示,发病年龄、性别、伴随的AID、AChR-ab滴度、泼尼松联合用药、他克莫司给药年龄和他克莫司减量速度均与减量相关复发相关。在多变量模型中,只有他克莫司降低速度仍然与泼尼松减药显著相关(表4)。
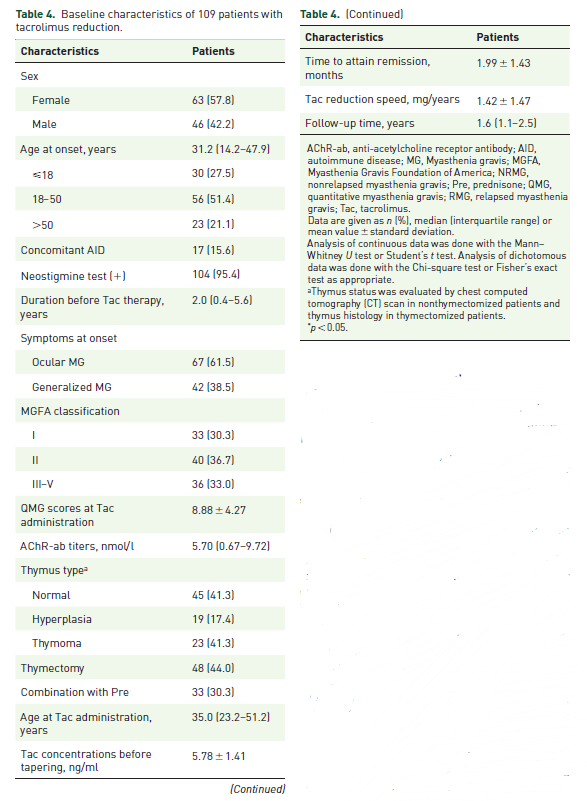
表4. 他克莫司减量过程中MG复发的单因素和多因素分析。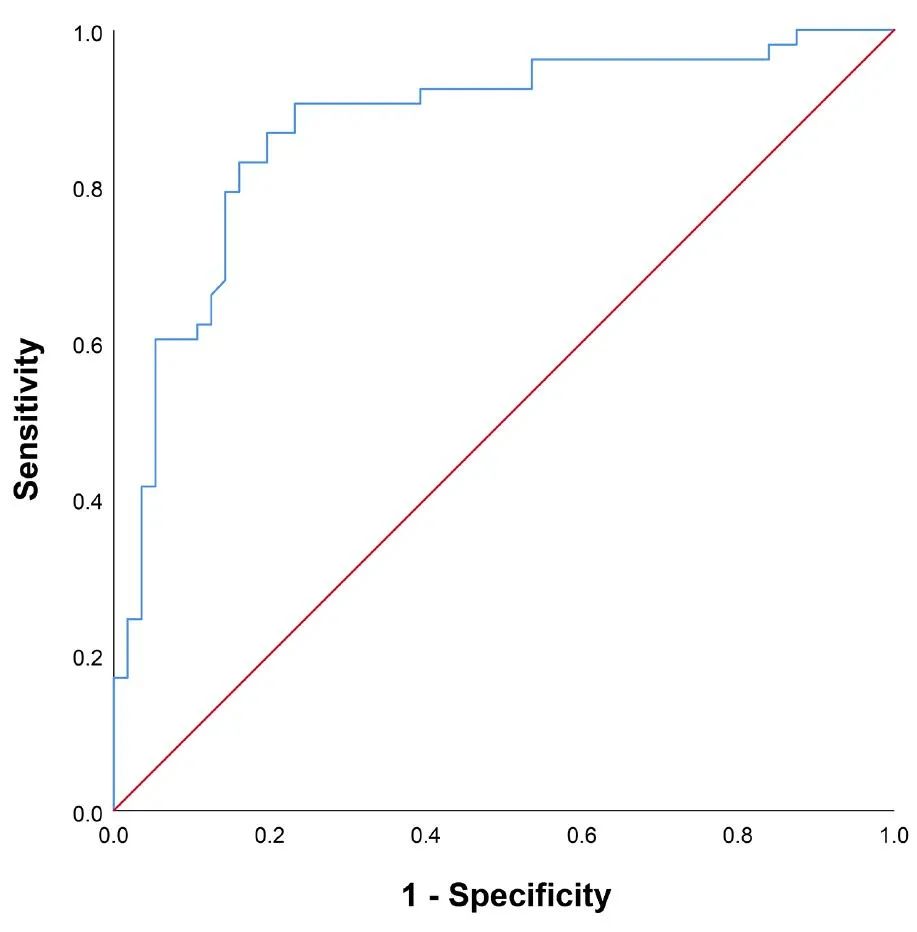
图3. 他克莫司减量后MG复发的受试者工作特征曲线分析。对于53名与他克莫司减量相关的复发患者,在将他克莫司剂量增加到之前的维持水平后2个月内,45名(84.9%)患者的症状得到了逆转。然而,6名(11.3%)患者需要住院接受静脉注射免疫球蛋白(IVIG)治疗,2名患者对他克莫司产生获得性耐药,且没有患者出现呼吸危象。在接受泼尼松和他克莫司治疗的患者的治疗结果方面,256名患者中只有20名(7.8%)在1.46至6.07年的可变时期后进入CSR。
这项研究表明性别、他克莫司浓度和QMG评分是影响接受他克莫司治疗的MG患者缓解时间的临床独立因素。尽管泼尼松在大多数MG患者中可以逐渐减量,但应谨慎使用,特别是在患有其他AID或AChR-Ab血清滴度较高的患者中。他克莫司作为预防疾病复发的维持药物,应缓慢减量,不超过0.76 mg/年。Bi Z, Cao Y, Liu C, Gui M, Lin J, Zhang Q, Li Y, Ji S, Bu B. Remission and relapses of myasthenia gravis on long-term tacrolimus: a retrospective cross-sectional study of a Chinese cohort. Ther Adv Chronic Dis. 2022 Sep 6;13:20406223221122538. doi: 10.1177/20406223221122538. PMID: 36093262; PMCID: PMC9459458.
目前,他克莫司作为一种免疫抑制剂,广泛应用于治疗MG。
本研究设计了一项回顾性横断面研究,纳入了256名MG患者,通过一系列统计分析,结果显示性别、他克莫司浓度和QMG评分是影响接受他克莫司治疗的MG患者缓解时间的临床独立因素。并且,在患有其他AID或AChR-ab血清滴度较高的MG患者中,泼尼松逐渐减量过程须格外谨慎。最后,研究提示他克莫司作为预防疾病复发的维持药物,应缓慢减量,不超过0.76 mg/年。
本研究有助于提供他克莫司治疗MG时长期疾病管理过程的参考。为了克服回顾性研究的局限性,进一步设计前瞻性,尤其是多中心的RCT研究,将更有助于我们深入的了解他克莫司。

本期编译:谢琰臣 博士 / Dr. Qi;点评:王玉鸽 博士;顾问:许贤豪 教授。
“征战重症肌无力”与各位同仁一起,学习重症肌无力的研究进展,探索更优的诊疗策略。
欢迎同仁投稿及分享,请和李尊波医生联系。微信号:li-zun-bo