
近年来,在心血管疾病治疗领域取得了重大发展,未来十年又将会发生怎么的变化?近日,在中华医学会二十四次全国心血管年会(CSC 2022)期间,复旦大学附属中山医院葛均波院士从以下四个方面展望了未来十年的心血管介入治疗。
在医学上,通常将人体分成多个系统、器官、细胞,当患者就医时便会“头痛医头、脚痛医脚”。然而,冠心病、心肌梗死、脑血管疾病、周围血管疾病、糖尿病等疾病,归根结底都属于血管疾病,“头痛医头、脚痛医脚”的传统治疗理念或不可行,应该将人体看成一个整体进行系统性诊治。泛血管理念便很好的体现了这一点。泛血管疾病是一组血管系统疾病,以动脉粥样硬化为共同病理特征,危害心脏、大脑、肾脏、四肢等重要器官。广义的泛血管是指小血管、微血管、静脉以及肿瘤、糖尿病和免疫。泛血管疾病以血管疾病的系统性、血管病理共性特征和血管共同危险因素为共同特征。高血压、高血脂、糖尿病、吸烟、遗传、肥胖、感染和免疫等均是其危险因素。泛血管疾病共同的病理基础是从正常血管到脂肪条纹、纤维斑块、粥样硬化斑块,最终导致斑块破裂/裂隙或血栓形成,这种完整的病理生理过程在全身血管中皆可发生,从而引起心梗(心脏)、脑卒中(脑部)、下肢缺血(外周血管)等。随着年龄增加,患者可同时合并多种血管病变,因此应将人作为一个整体来对待。从单一评估到综合评估,从局部评估到整体评估:
➤区别泛血管生理年龄和生物学年龄;
➤重视泛血管老化以及泛血管疾病的评估;
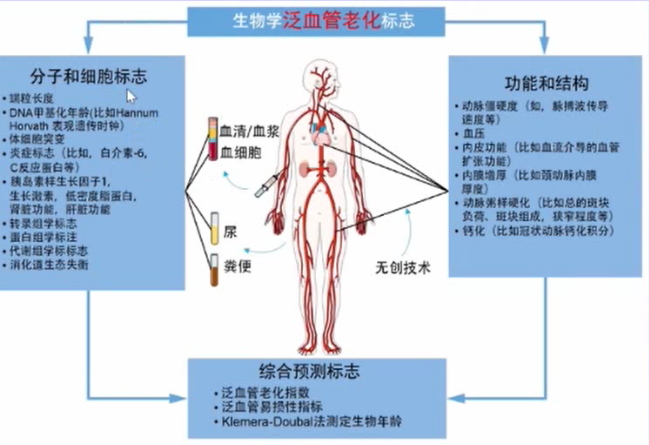 图1 生物学泛血管老化的标志近年来,在无创影像学和有创影像学的基础上,不断涌现出的多模态影像融合、分子影像、人工智能等新技术极大地提高了临床术者对泛血管疾病的认知。目前,比较明确的两个残余风险指标为残余胆固醇风险(LDL-C≥1.8mmoI/L)和残余炎症风险(hsCRP≥2 mg/L)。LDL-C越低越好,对于具有胆固醇残余风险的患者,可通过依折麦布、PCSK9抑制剂等来进一步降低风险。
图1 生物学泛血管老化的标志近年来,在无创影像学和有创影像学的基础上,不断涌现出的多模态影像融合、分子影像、人工智能等新技术极大地提高了临床术者对泛血管疾病的认知。目前,比较明确的两个残余风险指标为残余胆固醇风险(LDL-C≥1.8mmoI/L)和残余炎症风险(hsCRP≥2 mg/L)。LDL-C越低越好,对于具有胆固醇残余风险的患者,可通过依折麦布、PCSK9抑制剂等来进一步降低风险。上世纪中叶,我们便初步认识了残余炎症风险。近年来,发表的研究使我们对残余炎症风险有了更深入的了解:
2017年,CANTOS主要试验结果显示,卡那单抗对既往心梗史且存在持续炎症反应者再次出现的血管事件具备预防作用,可将主要终点风险降低15%。
2019年,COLCOT试验结果表明,小剂量秋水仙碱抑制炎症能降低心梗后事件的发生率。
2020年,LODOCO试验再次支持抗炎作为ASCVD残余风险的干预靶点。
总体而言,从理论上讲,干预炎症反应或为动脉粥样硬化防治的一种重要手段。
目前,冠脉介入已进入第四次革命,即冠脉介入无置入时代:
➤第一次革命:Gruertzig首次进行经皮腔内冠脉成形术(PTCA),开辟冠心病介入治疗新纪元;
➤第二次革命:法国医生Jacques Puel和瑞士医生Uirich Sigwart共同报告了首例临床PTCA后支架置入,介入诊疗进入裸金属支架(BMS)时代;
➤第三次革命:为解决BMS支架内再狭窄,药物洗脱支架(DES)应运而生,2003年Cypher支架,2004年Taxus支架;
➤第四次革命:冠脉介入无置入时代,包括完全可降解药物支架(BRS)和药物涂层球囊(DCB)。目前,已对中国首例介入无置入患者进行了5年的随访,发现其支架已完全降解,患者预后也较好。尽管如此,BRS仍有一定的缺陷,未来可在以下方面进行改进:
➤支架机械性能(支撑力):目前的可降解支架多为聚乳酸材质,其在支撑力方面存在一定的缺陷。现在研发的Zn、Mg、Fe合金支架或具有更好的支撑力;
➤支架通过性;
➤支架可视性(示踪性);
➤支架断裂;
最开始进行球囊扩张时,30%的患者在置入支架后会出现血管的急性闭塞。其原因与器械本身和抗血小板药物具有一定的相关性。目前,随着技术的发展和新型抗血小板药物的出现,很少有患者会出现血管急性闭塞的问题。随着冠脉内功能学技术的兴起和发展,冠脉介入领域正在逐步迈入“冠脉介入精准化时代”,并得到了FAME 2等研究的循证支持。血流储备分数(FFR)等技术的发展,有助于辅助临床医生更精准的明确哪些病变需要干预,从而更精准的指导介入治疗:
➤患者水平:从冠心病患者群体中,筛选出存在功能性缺血的患者;
➤血管水平:从多支病变血管中,分辨出功能性缺血、需要干预的血管;
➤病变水平:从多处病变中,找出功能性缺血、需要干预的病变并精准定位。除此之外,近些年还诞生了一系列的新FFRs产品,如QFR(定量血流分数)、OFR(基于OCT的FFR)、UFR(基于IVUS的FFR)等,均有助于精准化治疗的实现。
目前,瓣膜病介入治疗迅速发展,我国20多个省市的400余家医院中累计完成了18000例TAVR,相信未来10年,瓣膜病介入治疗将取得更大的进步。从最初的主动脉瓣、球扩瓣,到自扩张瓣膜,再到现在的一系列瓣膜体系,目前的瓣膜适应证已涉及到了全风险范围的主动脉瓣狭窄患者,之后的研究或攻克瓣膜关闭不全。在经皮二尖瓣介入治疗领域,COAPT试验结果的公布为心衰合并严重继发性二尖瓣反流患者带来了希望。2012年6月,葛均波院士团队成功完成了中国首例MitraClip植入,标志着我国二尖瓣介入治疗正式拉开序幕。目前,我国已成功完成了500例患者的缘对缘修复术(TEER)。2020年6月,基于COAPT试验结果,我国已批准了MitraClip的上市。在此基础上,我国又研发了一系列产品,包括换瓣技术、腱索修复和缘对缘体系等,相信在不久的将来一定会有更好的方法来进行补充或替代治疗。肺动脉瓣是一个相对小众的瓣膜,其主要针对法洛氏四联症儿童患者成人后的重度关闭不全。由于国外瓣膜并不适用于我国患者,因此我国学者将主动脉瓣膜的理念运用到肺动脉瓣膜之上,研发了具有自主知识产权的国产肺动脉瓣膜Venus P-Valve。目前,该瓣膜已完成了相关临床试验,且在今年获得了CE认证和NFDA批准。三尖瓣关闭不全是常见的心脏瓣膜病,在70岁以上人群中的发生率为0.4%。三尖瓣关闭不全的主要病因有左心瓣膜手术后、植入永久起搏器/除颤、心房纤颤和肺动脉高压。三尖瓣关闭不全与患者预后和生活质量息息相关,且由于结构和病情的复杂,外科手术治疗的死亡率较高,因此研究者希望可以通过经导管的方式来修复三尖瓣关闭不全。目前,我国自主研制的器械包括LUX-Valve系统、K-Clip™经导管三尖瓣环成形系统等。其中,Lux-Valve Plus三尖瓣置换系统的输送系统全面升级,可经颈静脉入路,进一步减少了创伤和风险。K-Clip™经导管三尖瓣环成形系统则可通过介入方式简单巧妙地还原Kay’s开胸术式的手术模式。此外,生物瓣膜衰败是目前人工生物瓣最主要的问题,可导致严重的瓣膜狭窄或反流,引起心脏扩大及心功能不全,患者再次外科手术的风险很高。聚合物瓣膜应运而生,其使用年限可达20-25年之久,显著延长了瓣膜的耐久性。今年,葛均波院士成功完成了世界首例聚合物瓣膜TAVR植入病例,标志着中国瓣膜病治疗领域正式跨入多聚合物时代。
AI赋能心血管疾病治疗在未来十年一定会有突飞猛进的发展。我国传统医疗通常是采用望、闻、问、切的诊疗方式询问患者病史和进行体检,但目前的疾病发病模式与之前完全不同。医疗数据的爆发式增长是AI应用强大的驱动力。值得注意的是,AI赋能冠心病诊疗并不仅仅是视频通话,而是在心血管领域从数据获取、证据判断、策略制订、器械置入到患者随访的闭环。未来,AI将渗透入冠心病诊疗的方方面面,在其辅助下,或将建立全新心血管疾病诊疗体系,为广大患者带来标准化、规范化的临床诊疗。