AD 的病因和发病机制尚不完全清楚,并且缺乏有效的疾病缓解药物治疗,但已证明遗传、年龄、氧化应激等因素均有助于AD的发生。为了阐明AD中神经退行性变的潜在机制,利用蛋白组学策略来评估分子网络不失为一种有效策略。大量证据表明蛋白翻译后修饰(PTM)可以调节多种信号通路,S-亚硝基化(SNO)就是一种PTM,一氧化氮通过S-亚硝基化反应将NO基团共价加到蛋白质的活性半胱氨酸巯基上形成S-亚硝基硫醇。已知异常的SNO可能在各种神经退行性疾病的发病机制中发挥关键作用,虽然已有课题组开发了多种策略来改进SNO蛋白分析,比如基于有机汞的 S-亚硝基硫醇富集和质谱分析,但SNO蛋白的准确定量在技术上还存在一定的挑战性。为此,来自美国斯克里普斯研究所的Stuart A. Lipton团队在Science Advances杂志上发表了一篇文章,题目是“Mechanistic insight into female predominance in Alzheimer’s disease based on aberrant protein Snitrosylation of C3”,他们使用改进的SNOTRAP(三芳基膦探针捕获SNO)方法并结合质谱分析,在AD和非AD个体尸检脑样本中检测到1449个SNO蛋白和2809个SNO位点,发现与男性AD个体相比,女性大脑中S-亚硝基化C3(补体成分3)水平升高,引起突触吞噬作用增强及随之而来的认知能力下降。由此研究显示,AD患者中S-亚硝基蛋白质组出现了显著改变,且这些改变以性别依赖的方式促进AD发生。研究人员使用改良的SNOTRAP方法进行基于纳米液相色谱串联质谱的半定量蛋白质组学分析,以发现可能有助于AD发病的关键SNO蛋白,从AD和非AD个体尸检脑样本中鉴定出1450个SNO蛋白和2809个SNO位点,其中,平均在每个AD大脑中识别出464个SNO蛋白和729个SNO位点,而在每个非AD大脑中识别出447个SNO蛋白和708个SNO位点,大约60%的SNO蛋白在AD组和非AD组之间是共同的,提示AD可能与SNO增加有关。就性别而言,在男性和女性中分别鉴定出1304和1241种SNO蛋白,其中257种和214种SNO蛋白分别只存在于男性AD和女性AD大脑中,两性组别之间存在广泛但不完全的重叠。对于在AD大脑中相对于非AD大脑有统计学意义的差异蛋白进行排序, PLD3、SQSTM1和补体成分3(C3)是列表中排名靠前的S-亚硝基化蛋白,对差异蛋白进行通路富集分析后,确定了蛋白质组中S-亚硝基化蛋白质具有统计学显著富集的通路,在男性和女性AD大脑的排名靠前的信号通路是“免疫反应-经典补体通路”、“氧化应激_抗氧化防御系统的激活”等。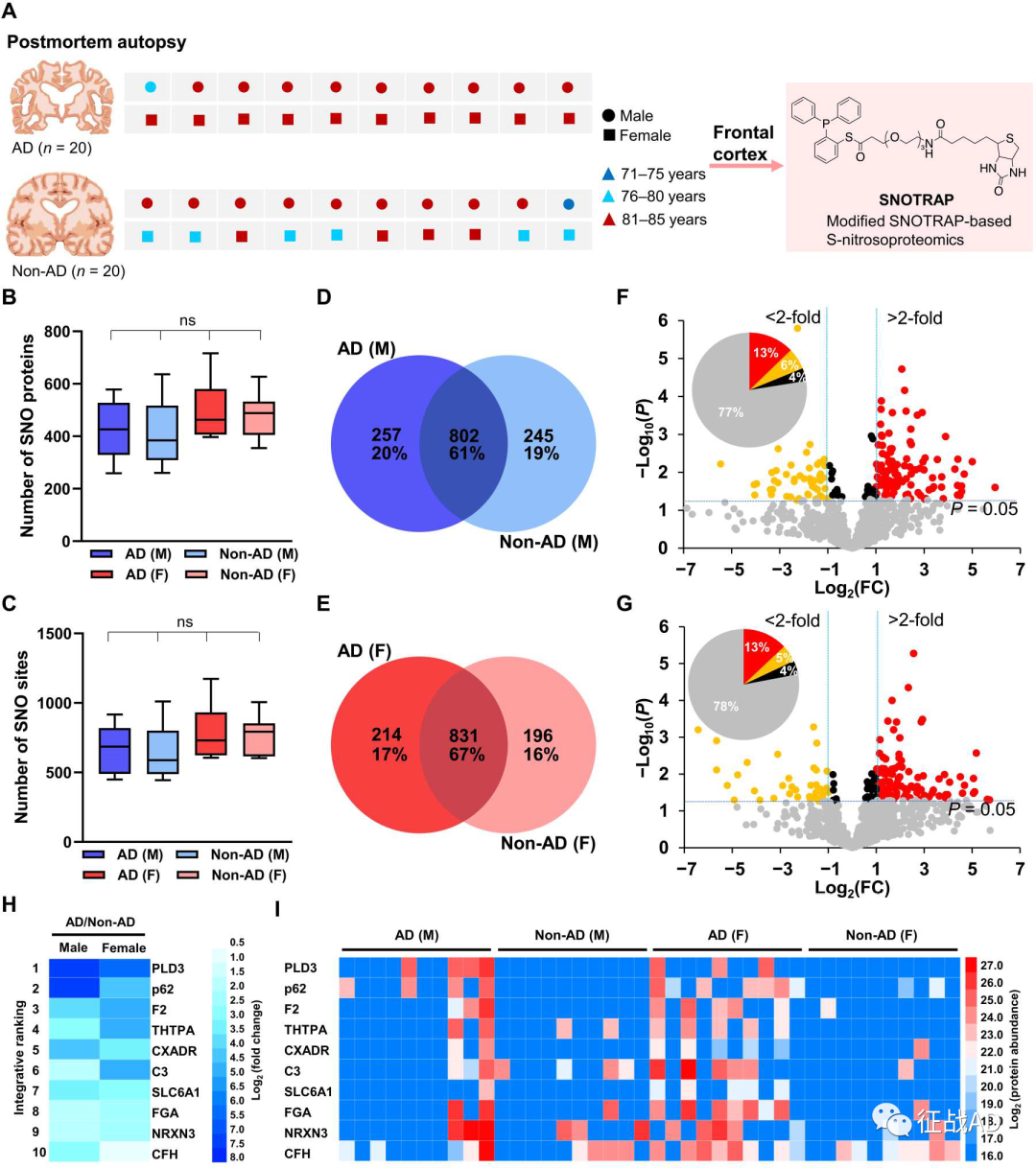
图1. 通过SNO蛋白质组学研究男性AD和女性AD与非AD大脑中SNO蛋白的特征。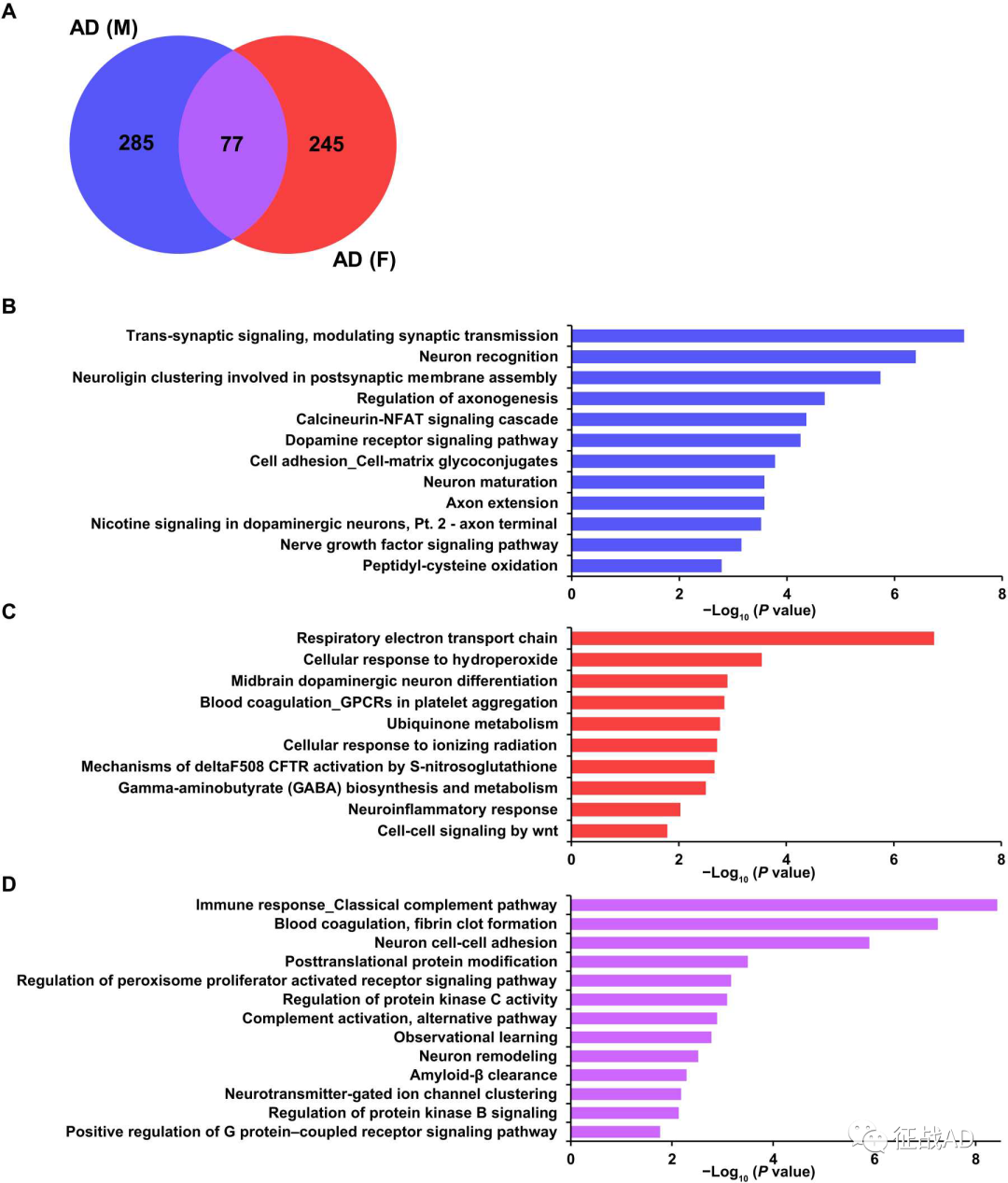
图2. 系统生物学分析的男性和女性AD人脑中s -亚硝基蛋白质组的差异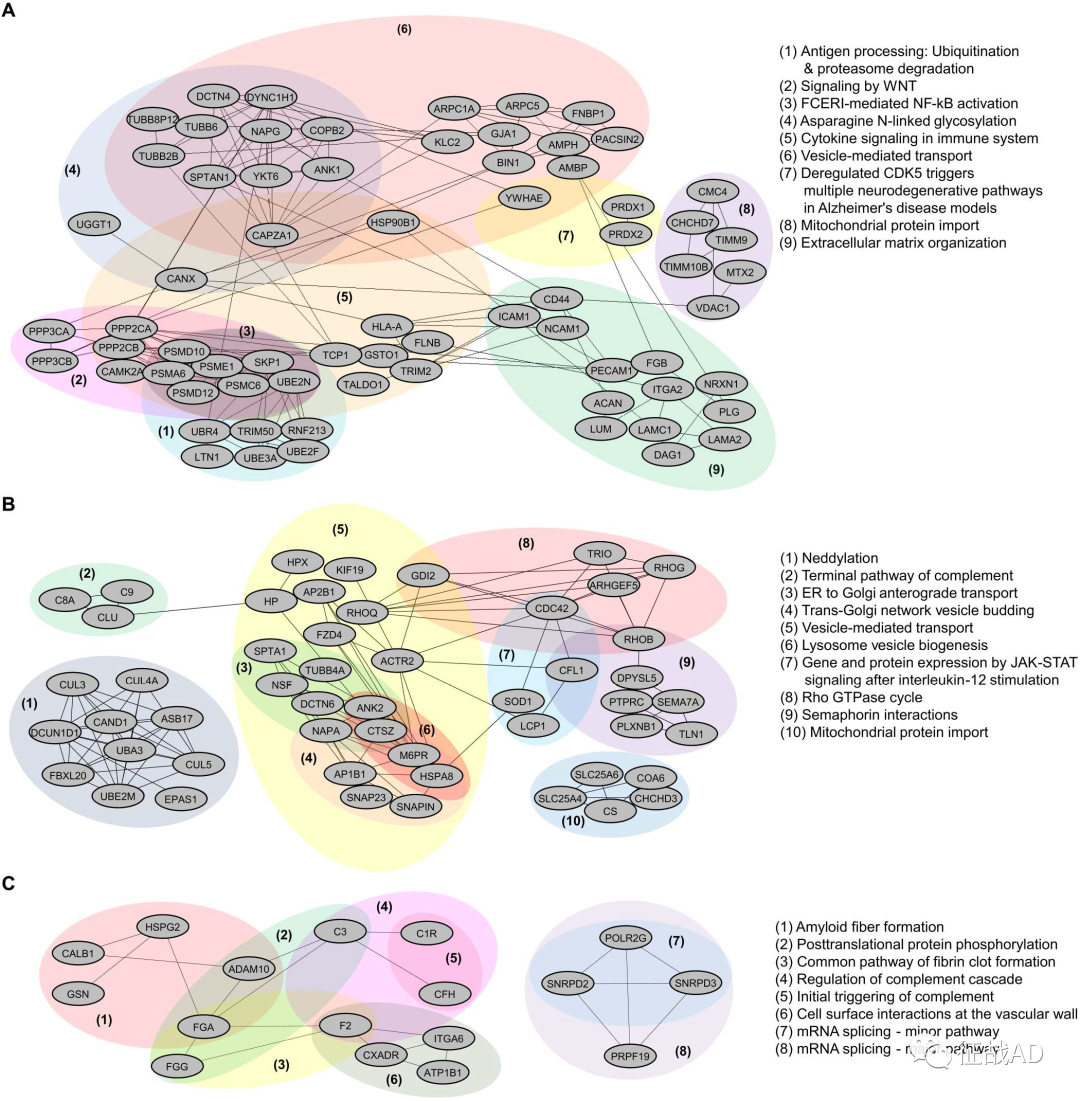
为了确认上述利用SNOTRAP鉴定的ANO蛋白的准确性,研究人员进一步检索了质谱数据库以寻找证据,证明在正确的色谱保留时间质荷比下存在独特的SNO肽,且在串联质谱中观察到适当的产物离子。第二点,为了确保通过SNOTRAP和MS分析确认蛋白质组学定量的稳健性,研究人员在通过SNOTRAP富集后通过免疫印迹分析检查了SNO-p62、SNO-C3、SNO-NRXN3和SNO-PLD3的水平,结果显示与非AD组相比,AD中S-亚硝基化p62、C3、NRXN3和PLD3的水平显著增加。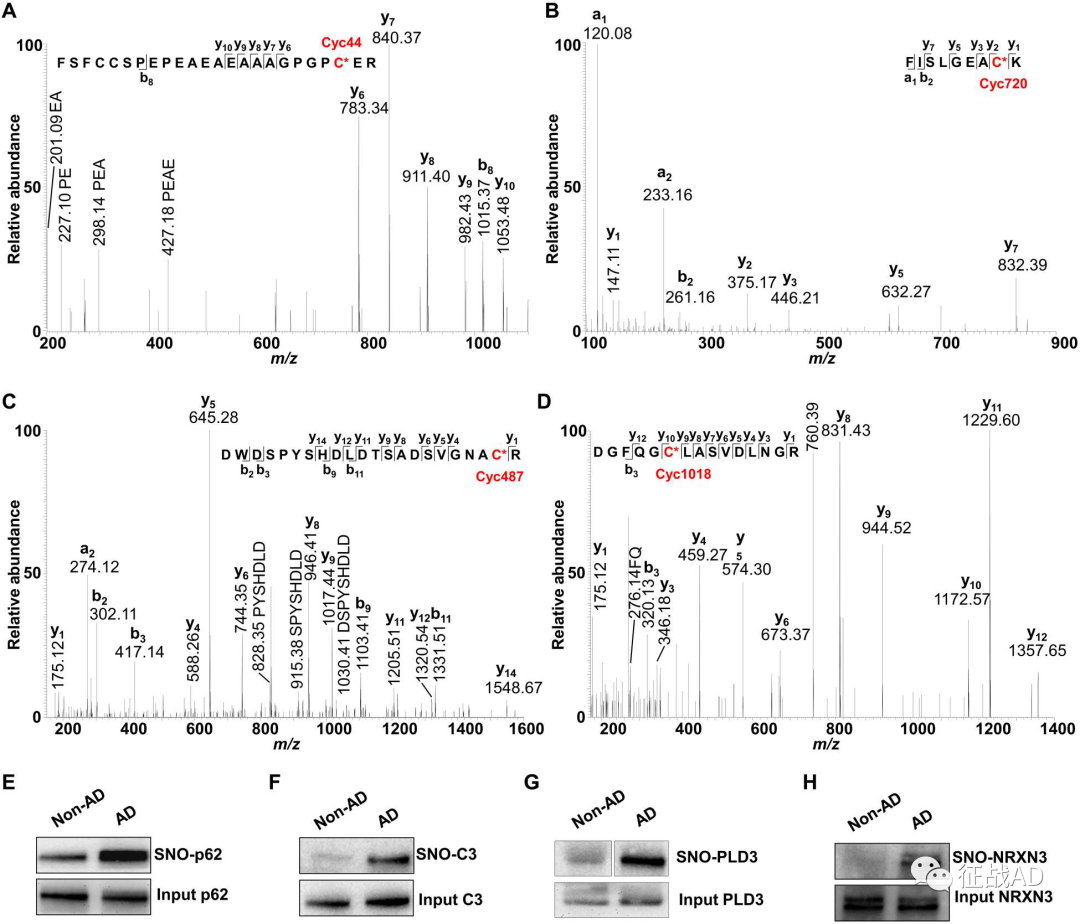
图4.串联质谱显示p62 (Cys44)、C3 (Cys720)、PLD3 (Cys487)和NRXN3 (Cys1018)的SNO,并通过免疫印迹实验验证。补体因子C3在先天免疫系统中起着关键作用,是AD大脑中最丰富的S-亚硝基化蛋白之一,且先前已证明与AD病理学相关联,但未被识别为S-亚硝基化或以性别特异性方式分布。在上述SNO蛋白数据集中,研究人员观察到女性AD大脑中SNO-C3显著增加,通过Spectrum Mill定量分析显示女性非AD对照大脑增加34.2倍,而男性AD大脑仅表现出比他们各自的非AD大脑增加5.6倍。C3的SNO主要发生在Cys720位点,10个男性AD样本中有3个的Cys720 SNO水平略有升高,而在10个女性AD样本中的5个显著升高,提示女性与男性AD大脑中C3 (SNO-Cys720) SNO的性别差异。随后,研究人员利用人诱导多能干细胞(hiPSC)衍生的脑小胶质细胞(hiMG)模型系统,将hiMG 暴露于Aβ寡聚体,为了进一步提高NO水平,他们还将hiMG暴露于低浓度LPS或内毒素,从而导致足够的SNO-C3被检测到但能被β-雌二醇抑制,而β-雌二醇的非雌性异构体α-雌二醇不能抑制SNO-C3的产生,说明β-雌二醇可以保护女性免受C3异常SNO的影响。然而,在女性绝经后,雌激素水平下降,特别是在存在低度感染(例如,产LPS大肠杆菌的尿路感染,这在女性中很常见)的情况下,C3会被S-亚硝基化。已知Cys720位点位于C3上参与触发小胶质细胞吞噬作用的结构域,为了确认这一位点在AD发病中的作用,作者构建了一个不可被亚硝基化的C3突变体(C720A,也就是把半胱氨酸突变为丙氨酸),将野生型C3和突变体与iNOS(一氧化氮合酶)共转染,随后分别取两种培养基。用野生型C3而非非亚硝基化突变体C3(C720A)转染的细胞培养基可以增加hiMG对突触体膜的吞噬作用,而在添加NOS抑制剂后则能阻断这种吞噬作用。这些发现说明内源性NO的产生可触发C3发生SNO,从而激活小胶质细胞的吞噬作用及随之发生的突触异常。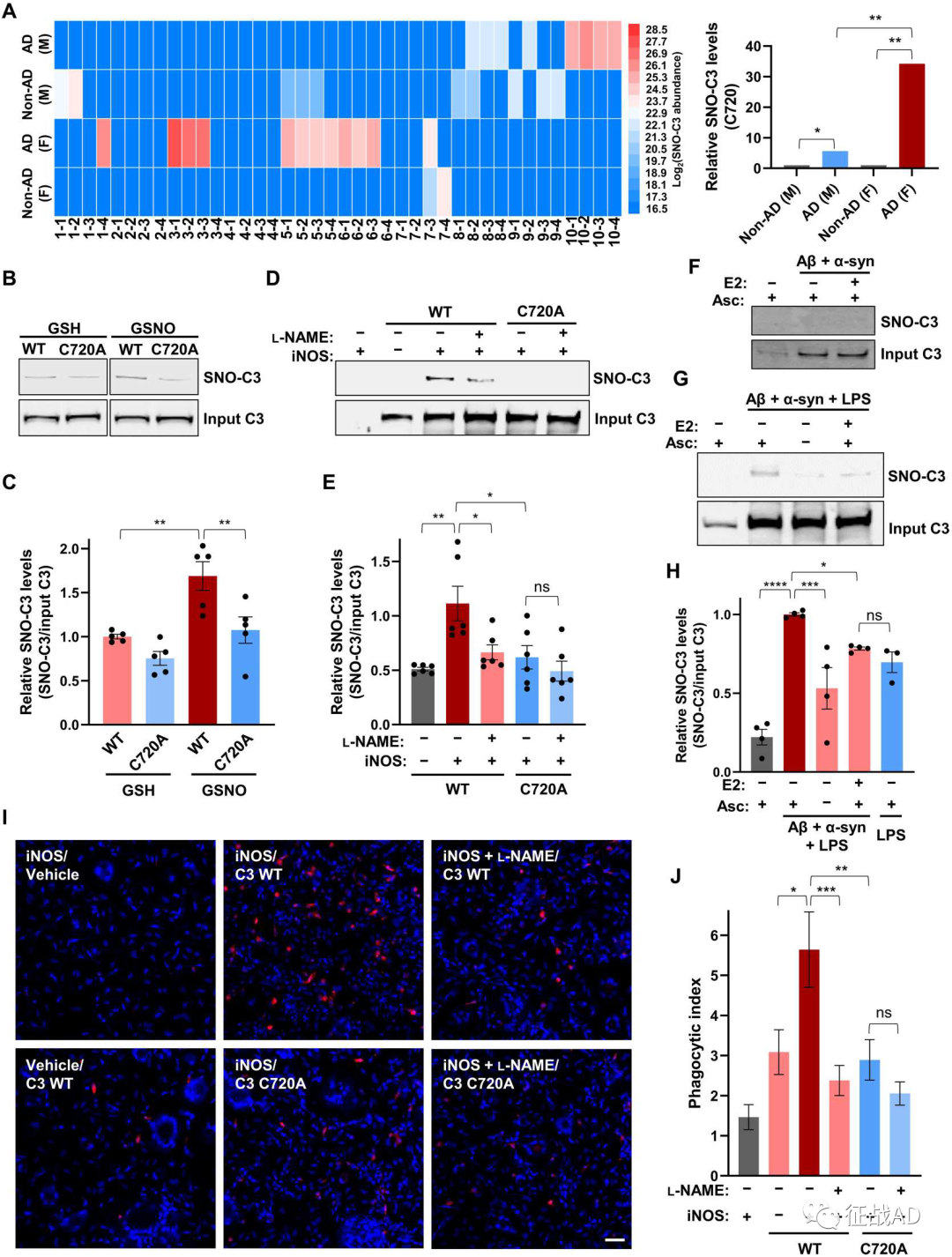
图5. 女性AD大脑C3的SNO增加了人小胶质细胞(hiMG)的突触吞噬作用。
1)先前的工作虽然已将神经元和神经胶质细胞中的SNO蛋白与AD相联系,但这些S-亚硝基化蛋白质通常以低丰度存在,最多也只能检测到大约几百个SNO蛋白质。而这项工作使用敏感的SNOTRAP探针进行深入、严格的SNO蛋白质组分析,具备高特异性和技术重现性,将男性和女性AD人脑中的SNO位点与其各自的非AD对照进行比较和排序,在40个人脑样本中鉴定了近1500个SNO蛋白和近3000个SNO位点,并首次表明蛋白质SNO可能会影响这些蛋白质在人类AD大脑中的功能。2)此外,AD治疗方法的开发在一定程度上受到了缺乏敏感和特异性生物标志物和疾病进展靶点的阻碍,治疗靶点和生物标志物的发现和验证仍然是一个重要的研究兴趣,之前的研究已经表明p62、PLD和C3都与一般的神经退行性疾病(尤其是AD)有关,而在这里,上述的每一种都在AD大脑中被S-亚硝基化。3)最重要的一点是,他们提供证据表明β-雌二醇水平下降会导致iNOS表达增加,从而促进SNO-C3的产生。4)因此,补体系统失调可能在AD的发病机制中发挥作用,并至少部分解释了该疾病的女性优势。原文链接:
Yang H, Oh CK, Amal H, Wishnok JS, Lewis S, Schahrer E, Trudler D, Nakamura T, Tannenbaum SR, Lipton SA. Mechanistic insight into female predominance in Alzheimer's disease based on aberrant protein S-nitrosylation of C3. Sci Adv. 2022 Dec 14;8(50):eade0764. doi: 10.1126/sciadv.ade0764. Epub 2022 Dec 14. PMID: 36516243; PMCID: PMC9750152.
编辑:Daniel,微信号:Healsanc。作者:Dr. Qi