来源:深究科学
作者:漩涡君的另一半
解脱感(relief)是痛苦结束之后的一种快感,在日常生活中随处可见。忙碌一天后下班时的轻松、紧张考试交卷后的愉悦,成语“如释重负”很好地描述了这种以痛苦为前提的快乐。
作为一种特别常见的现象,解脱感是如何产生的?其生物学基础是什么?解脱感的存在,对于人类又有什么样的意义呢?
 胡海岚教授最新成果,董一言为论文第一作者
胡海岚教授最新成果,董一言为论文第一作者
2023年9月29日,浙江大学胡海岚教授团队在Neuron杂志发文“Stress Relief as a Natural Resilience Mechanism against Depression-like Behaviors”(论文第一作者为董一言博士),揭示了解脱感是生物体内天然对抗抑郁症的一种韧性机制,并且阐明了解脱感产生的大脑原理。
他们发现,两条独立的多巴胺神经环路共同编码了解脱感,并且各自预防了不同的抑郁症状。基于解脱感的生理意义,研究团队还提出了一种无需药物的无创行为疗法,为现实世界中抑郁症的预防和早期干预提供了可操作的新思路。

解脱快感,古已有之。早在古希腊时期,柏拉图在其“理想国三部曲”的第二部《斐多篇》中,就详细描述了他的导师苏格拉底在慷慨赴死之前体会到的解脱感。当紧紧缠绕在他腿上的锁链被解开、腿部的疼痛逐渐消退后,苏格拉底居然感到一阵前所未有的欢愉,不由高声感慨:“快乐和痛苦从不同时出现,可是如果你想要其中之一,另一个都将如影随形!”
事实上,解脱感反映了人类情绪的一种天然特性:一种强烈情绪的结束会自然伴生另一种相反的情绪。乐极生悲、苦尽甘来,汉语的艺术早已生动描绘了这些常见的现象。
上世纪七十年代,著名心理学家Solomon将这些现象总结归纳为“对立过程理论”(opponent-process theory),并猜测这可能是人体维持情绪稳态的防火墙 [1,2]。
在过去的几十年间,“对立过程理论”被成瘾领域的科学家奉为圭臬。因为该理论极为贴切地描绘了一种“快乐之后的痛苦”:在毒品的强烈快感消退后,成瘾者会陷入十分痛苦的戒断状态[3-5]。为了逃避戒断时的痛苦,成瘾者疯狂地寻觅毒品,进一步滑向黑暗的深渊。学界对于戒断的研究已经取得了大量进展[6-11],然而对于解脱感却关注甚少。

为此,胡海岚团队对解脱感开展了一系列研究。首先,为了测量解脱感这一主观体验,团队成员借鉴了经典的条件性位置偏好(conditioned place preference, CPP)范式,将小鼠的解脱感和特定位置进行匹配,发现小鼠更偏爱曾经发生过解脱的那个位置,从而为解脱感提供了可量化的行为学指标。由于每只小鼠对解脱感相关位置的偏好程度各不相同,可用于衡量小鼠的解脱感强度,团队成员进一步发现解脱感的强度和小鼠对抑郁症的韧性水平呈正相关。也就是说,越解脱,越坚强。
结合药理学、光遗传学等技术,团队成员发现阻断解脱感能促进小鼠的抑郁样行为,而增强解脱感能预防小鼠的抑郁样行为,从而双向验证了解脱感和心理韧性之间的因果关系。
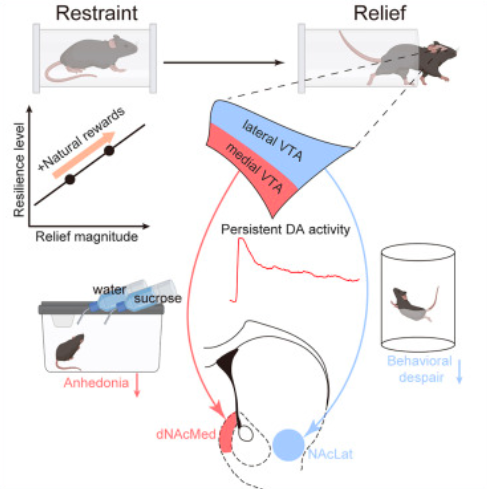
解脱感是如何产生的?其神经机制是什么?运用光纤记录、光标记在体电生理、光遗传等技术,团队成员精准描绘了编码解脱感的多巴胺亚群神经环路,发现腹侧被盖区(VTA)有两群分离的多巴胺(DA)神经元,分别投射至伏隔核背内侧壳(dNAcMed)和伏隔核外侧壳(NAcLat),共同编码了解脱感,并且分别预防了快感缺失和行为绝望这两种不同的抑郁症核心症状。这些发现阐释了多巴胺系统的功能异质性,为靶向相关环路的精准治疗提供了理论基础。
这一系列研究成果揭示了解脱感对于生物体的关键意义:一种内在的抗抑郁机制,用于抵御压力的危害、预防抑郁的发生。基于对解脱感的深入理解,团队成员最终提出了一种无需药物的无创行为疗法:在小鼠每天遭受压力后,及时给予奖励(糖水和巧克力),可以长期预防抑郁行为的发生。这一行为策略为现实世界中抑郁症的预防和早期干预提供了可操作的新思路。此外,研究人员还发现该策略存在一个小时级别的关键期:只有在每天压力结束后的2小时内给予奖励,才能有效预防抑郁行为。
这提示奖励本身并不足以预防抑郁行为,而必须在解脱感的时间窗内增强其奖赏效应,才能阻断抑郁的发生。
令人惊讶的是,这种小时级别的时间窗远远长于解脱感分钟级别的时间窗,提示外源性的奖赏供应可以延长内源性的解脱感,从而增强了这种行为抗抑郁策略的可操作性。
更重要的问题是,为什么会有这样的关键期?什么样的生物学机制造就了这一关键期?理解其中的机制(如多巴胺调控下的神经可塑性变化、基因调控等),将有助于开发更多抑郁症的早期干预方法。
论文链接:https://www.cell.com/neuron/fulltext/S0896-6273(23)00668-2
1. Solomon, R.L., and Corbit, J.D. (1974). An opponent-process theory of motivation. I. Temporal dynamics of affect. Psychol Rev 81, 119-145. 10.1037/h0036128.2. Solomon, R.L. (1980). The opponent-process theory of acquired motivation: the costs of pleasure and the benefits of pain. Am Psychol 35, 691-712. 10.1037//0003-066x.35.8.691.3. Koob, G.F. (2020). Neurobiology of Opioid Addiction: Opponent Process, Hyperkatifeia, and Negative Reinforcement. Biol Psychiatry 87, 44-53. 10.1016/j.biopsych.2019.05.023.4. Wikler, A. (1973). Dynamics of drug dependence. Implications of a conditioning theory for research and treatment. Arch Gen Psychiatry 28, 611-616. 10.1001/archpsyc.1973.01750350005001.5. Koob, G.F., and Le Moal, M. (1997). Drug abuse: hedonic homeostatic dysregulation. Science 278, 52-58. 10.1126/science.278.5335.52.6. Delfs, J.M., Zhu, Y., Druhan, J.P., and Aston-Jones, G. (2000). Noradrenaline in the ventral forebrain is critical for opiate withdrawal-induced aversion. Nature 403, 430-434. 10.1038/35000212.7. Frahm, S., Slimak, M.A., Ferrarese, L., Santos-Torres, J., Antolin-Fontes, B., Auer, S., Filkin, S., Pons, S., Fontaine, J.F., Tsetlin, V., et al. (2011). Aversion to nicotine is regulated by the balanced activity of beta4 and alpha5 nicotinic receptor subunits in the medial habenula. Neuron 70, 522-535. 10.1016/j.neuron.2011.04.013.8. Fowler, C.D., Lu, Q., Johnson, P.M., Marks, M.J., and Kenny, P.J. (2011). Habenular alpha5 nicotinic receptor subunit signalling controls nicotine intake. Nature 471, 597-601. 10.1038/nature09797.9. Meye, F.J., Valentinova, K., Lecca, S., Marion-Poll, L., Maroteaux, M.J., Musardo, S., Moutkine, I., Gardoni, F., Huganir, R.L., Georges, F., and Mameli, M. (2015). Cocaine-evoked negative symptoms require AMPA receptor trafficking in the lateral habenula. Nat Neurosci 18, 376-378. 10.1038/nn.3923.10. Zhu, Y., Wienecke, C.F., Nachtrab, G., and Chen, X. (2016). A thalamic input to the nucleus accumbens mediates opiate dependence. Nature 530, 219-222. 10.1038/nature16954.11. Jiang, C., Yang, X., He, G., Wang, F., Wang, Z., Xu, W., Mao, Y., Ma, L., and Wang, F. (2021). CRH(CeA-->VTA) inputs inhibit the positive ensembles to induce negative effect of opiate withdrawal. Mol Psychiatry 26, 6170-6186. 10.1038/s41380-021-01321-9.
胡海岚教授最新成果,董一言为论文第一作者