来源:中华麻醉学杂志
术后谵妄(POD)是一种以急性暂时性中枢神经系统功能异常为特征的疾病,通常发生在术后3~5 d内,对患者预后产生不良影响[1]。目前POD治疗仍以预防为主[2],因此,探讨POD的影响因素有重要意义。研究发现脑脊液(CSF)β淀粉样蛋白(Aβ)和tau蛋白与神经功能异常有关[3,4,5,6,7],是POD发生机制的核心蛋白[8,9]。血清尿酸水平(SUA)也可能是影响POD的因素之一[10,11]。尿酸既有强大的抗氧化作用也具有促氧化作用,这种双重作用可能取决于过渡金属的存在[12,13]。同时,尿酸与多种血管性疾病有关,进而影响认知功能[14]。因此本研究拟评价术前SUA与POD的关系,为POD的早期预防提供参考。
本研究已通过青岛市市立医院伦理委员会批准(2020临审字Y第005号),并均获得患者或其法定代理人的书面知情同意。选择2020年9月至2021年12月在青岛市市立医院择期行脊椎-硬膜外联合麻醉下膝关节置换术患者750例,性别不限,年龄50~90岁,ASA分级Ⅰ或Ⅱ级。(1)术前简易智力状态检查量表(MMSE)评分<24分;(2)吸毒、滥用精神药品以及长期使用类固醇、激素类药物;(6)中枢神经系统感染、头部外伤、多发性硬化症、阿尔兹海默病、神经退行性疾病(如癫痫、帕金森病)或其他严重神经系统疾病;(8)可能影响CSF或血液生物标志物[包括Aβ和tau蛋白]水平的严重全身性疾病(如恶性肿瘤);患者术前均未接受药物治疗,术前禁饮6 h,禁食8 h。入室后常规监测ECG、SpO2和无创BP,开放外周静脉血管通路并采集静脉血样3 ml。取侧卧位,以L3,4为穿刺间隙行脊椎-硬膜外联合麻醉,从蛛网膜下腔抽取CSF标本2 ml,并在2 h内送至实验室,以2 000×g离心10 min,分离并储存在-80 ℃的无酶EP管中。向蛛网膜下腔注射0.67%罗哌卡因2.0~2.5 ml,注药时间约为30 s,感觉平面控制在T8水平以下。术中面罩吸氧5 L/min,维持患者血压波动不超过基础值的20%。若术中收缩压<90 mmHg(1 mmHg=0.133 kPa)或下降超过基础值的20%时,静脉注射麻黄碱5 mg。若术中心率<50次/min,静脉注射阿托品0.5 mg。术后镇痛采用PCIA,药物为布托啡诺10 mg+托烷司琼5 mg+0.9%氯化钠溶液89 ml,维持术后3 d疼痛数字评分<3分。手术结束后,送入PACU观察30 min,若无异常,则送回病房。采用酶偶联法测定SUA。采用ELISA法测定CSF中Aβ42、总tau蛋白(t-tau)、磷酸化tau蛋白(p-tau)的浓度。取出装有CSF的EP管以及试剂盒在室温下进行解冻及相关准备工作。酶标板设空白孔和7孔标准孔,依次完成加样、温育和避光显色等操作,用酶标仪在450 nm波长处测定各孔的光密度值。本研究中所有CSF标本均由有资质的技术人员采用相同的方法进行采样和分析。记录患者年龄、性别、受教育年限、术前MMSE评分、并存疾病(高血压、糖尿病)、吸烟史及饮酒史等。麻醉医生于术后1~7 d(或出院前)的每天上午9:00至10:00和下午2:00至3:00采用意识模糊评估法(CAM)和谵妄程度评估量表(MDAS)评估POD发生情况和严重程度[15,16]。POD诊断标准:(4)意识水平改变;必须同时满足(1)和(2)标准,再加(3)和/或(4)。根据高尿酸血症临床诊断标准(男性SUA≥416.5 μmol/L,女性SUA≥357 μmol/L)[17],将患者分为高尿酸组(HS组)和非高尿酸组(NS组)。根据是否发生POD分为POD组和非POD组(NPOD组)。采用SPSS 20.0软件进行分析。正态分布的计量资料以均数±标准差( ±s)表示,组间比较采用两独立样本t检验,偏态分布的计量资料以中位数(四分位数间距)[M(IQR)]表示,组间比较采用Mann-Whitney U检验。计数资料比较采用χ2检验。采用R-4.1.0软件分析组间CSF生物标志物浓度的差异。采用单因素二元logistic回归分析SUA、CSF生物标志物浓度与POD的关系[模型(1)]。进一步使用多因素二元logistic回归进行敏感性分析,构建三种校正模型:模型(2)纳入年龄、性别、受教育年限和MMSE评分;模型(3)在模型(2)基础上纳入高血压病史、糖尿病病史、吸烟史和饮酒史;模型(4)在模型(3)的基础上进一步限制年龄≥65岁。将线性模型引入交互项(SUA×性别),探究性别对SUA是否具有潜在的效应修饰作用。若交互项显著,则进行下一步效应分析。采用Stata MP 16.0软件进行中介效应分析,检验SUA和POD之间的联系是否由CSF生物标志物介导。第1个方程将自变量(SUA)与中介变量(CSF生物标记物浓度)进行回归。第2个方程将因变量(POD)与自变量进行回归。第3个方程将因变量在自变量和中介变量上进行回归。如果同时达到以下标准,则可以建立中介效应:(1)SUA与CSF生物标志物浓度具有相关性;(2)SUA与POD具有或不具有相关性;(3)CSF生物标志物浓度与POD具有相关性;(4)回归模型中加入CSF生物标志物(中介物)后,SUA与POD的相关性减弱。使用10 000次bootstrapped迭代确定相关性,估计间接效应。模型的每条路径都对年龄、性别、受教育年限和MMSE进行控制。采用GraphPad Prism 7绘制受试者工作特征曲线(ROC)并计算曲线下面积(AUC),评价SUA和CSF生物标志物浓度预测POD的效能。P<0.05为差异有统计学意义。
±s)表示,组间比较采用两独立样本t检验,偏态分布的计量资料以中位数(四分位数间距)[M(IQR)]表示,组间比较采用Mann-Whitney U检验。计数资料比较采用χ2检验。采用R-4.1.0软件分析组间CSF生物标志物浓度的差异。采用单因素二元logistic回归分析SUA、CSF生物标志物浓度与POD的关系[模型(1)]。进一步使用多因素二元logistic回归进行敏感性分析,构建三种校正模型:模型(2)纳入年龄、性别、受教育年限和MMSE评分;模型(3)在模型(2)基础上纳入高血压病史、糖尿病病史、吸烟史和饮酒史;模型(4)在模型(3)的基础上进一步限制年龄≥65岁。将线性模型引入交互项(SUA×性别),探究性别对SUA是否具有潜在的效应修饰作用。若交互项显著,则进行下一步效应分析。采用Stata MP 16.0软件进行中介效应分析,检验SUA和POD之间的联系是否由CSF生物标志物介导。第1个方程将自变量(SUA)与中介变量(CSF生物标记物浓度)进行回归。第2个方程将因变量(POD)与自变量进行回归。第3个方程将因变量在自变量和中介变量上进行回归。如果同时达到以下标准,则可以建立中介效应:(1)SUA与CSF生物标志物浓度具有相关性;(2)SUA与POD具有或不具有相关性;(3)CSF生物标志物浓度与POD具有相关性;(4)回归模型中加入CSF生物标志物(中介物)后,SUA与POD的相关性减弱。使用10 000次bootstrapped迭代确定相关性,估计间接效应。模型的每条路径都对年龄、性别、受教育年限和MMSE进行控制。采用GraphPad Prism 7绘制受试者工作特征曲线(ROC)并计算曲线下面积(AUC),评价SUA和CSF生物标志物浓度预测POD的效能。P<0.05为差异有统计学意义。
23例患者或家属拒绝参加本研究,21例未获得标本(麻醉方式变更、手术取消等),7例由于其他原因未纳入研究,最终纳入699例患者。其中150例发生POD,POD发生率为21.5%。NS组与HS组患者年龄、男性比率、吸烟史比率、高血压和糖尿病比率、POD发生率及MDAS评分、CSF Aβ42和p-tau浓度、Aβ42/p-tau比值、Aβ42/t-tau比值比较差异有统计学意义(P<0.05),见表1。
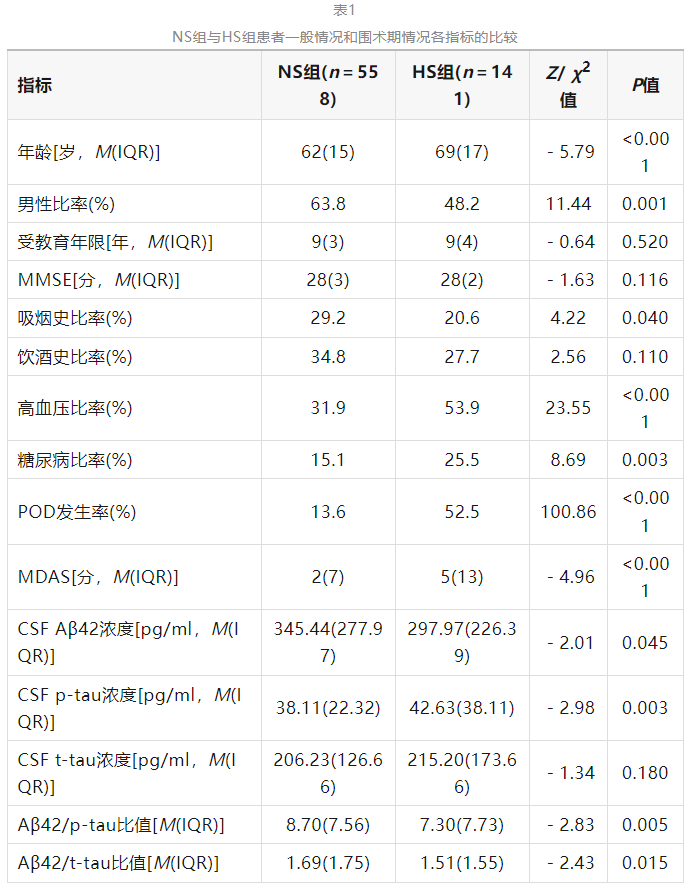
注:MMSE为简易智力状态检查量表,POD为术后谵妄,MDAS为谵妄程度评估量表,CSF为脑脊液,Aβ42为β淀粉样蛋白42,p-tau为磷酸化tau蛋白,t-tau为总tau蛋白
NPOD组与POD组患者SUA、CSF Aβ42、p-tau和t-tau浓度、Aβ42/p-tau比值和Aβ42/t-tau比值差异有统计学意义(P<0.05),见表2。
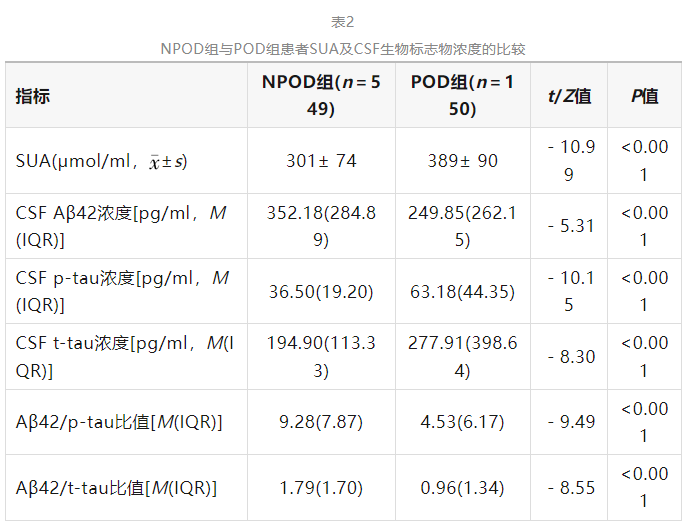
注:SUA为血清尿酸水平,CSF为脑脊液,Aβ42为β淀粉样蛋白42,p-tau为磷酸化tau蛋白,t-tau为总tau蛋白
logistic回归分析在校正年龄、性别、受教育年限、MMSE评分、吸烟史、饮酒史、高血压和糖尿病病史等多项混杂因素后的结果显示,SUA、CSF p-tau和t-tau浓度升高为POD的危险因素,CSF Aβ42浓度、Aβ42/p-tau比值、Aβ42/t-tau比值升高是POD的保护因素(P<0.05),见表3。
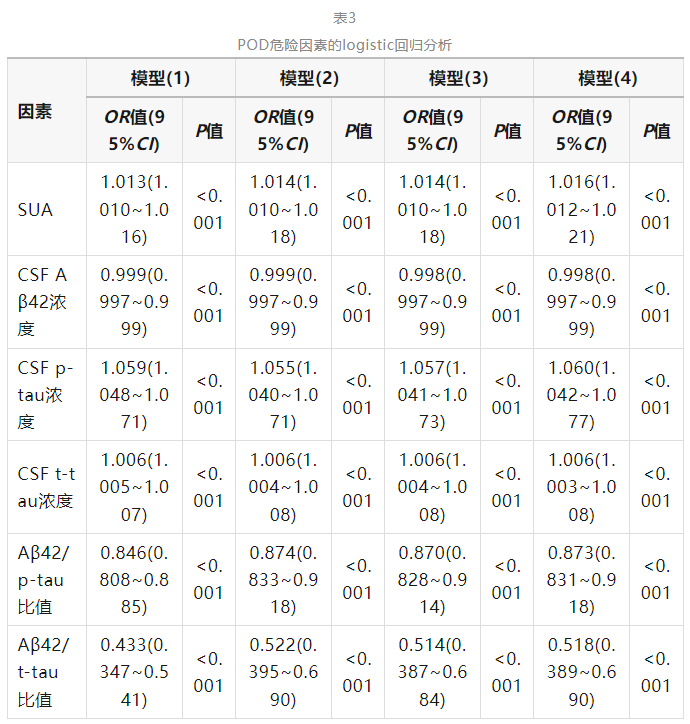
注:POD为术后谵妄,SUA为血清尿酸水平,CSF为脑脊液,Aβ42为β淀粉样蛋白42,p-tau为磷酸化tau蛋白,t-tau为总tau蛋白
交互效应分析显示SUA与性别不存在交互效应(P>0.05),见表4。
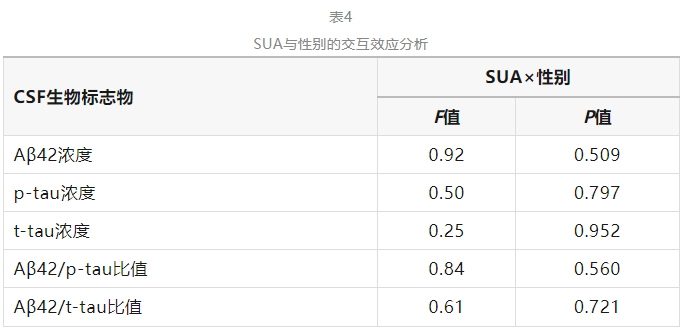
注:SUA为血清尿酸水平,CSF为脑脊液,Aβ42为β淀粉样蛋白42,p-tau为磷酸化tau蛋白,t-tau为总tau蛋白
中介效应分析结果示,CSF p-tau和t-tau浓度是SUA和POD之间关系的中介因子,中介效应分别为0.000 301(95%CI 0~0.000 152)和0.000 236(95%CI 0~0.000 092),中介比例分别为14.9%和11.7%,见图1。
图1
SUA与POD中介效应分析

注:SUA为血清尿酸水平,POD为术后谵妄,Aβ42为β淀粉样蛋白42,p-tau为磷酸化tau蛋白,t-tau为总tau蛋白,IE为中介变量的间接效应
SUA和CSF生物标志物预测POD的AUC分别为AUCSUA 0.774、AUCAβ42 0.641、AUCp-tau 0.770、AUCt-tau0.721、AUCAβ42/p-tau 0.753、AUCAβ42/t-tau 0.728(P<0.05),见图2。
图2
SUA和CSF生物标志物浓度预测POD的ROC曲线

注:SUA为血清尿酸水平,CSF为脑脊液,POD为术后谵妄,Aβ42为β淀粉样蛋白42,p-tau为磷酸化tau蛋白,t-tau为总tau蛋白,ROC为受试者工作特征曲线,AUC为曲线下面积
本研究预计有9个协变量进入logistic回归,假设POD发生率为15%,失访率为20%,因此计算所需样本量为750例。研究表明,男性SUA高于女性[18],提示SUA可能具有性别差异。因此,为了排除性别对结果的影响,本研究采用具有性别特异性的高尿酸血症临床诊断标准将患者分为HS组和NS组。本研究参照文献[14]采用CAM量表来评估POD发生情况。CAM量表是一种具有高灵敏度和特异度的谵妄可靠性评价方法,特别适用于易患人群(如住院老年患者)。结果表明,POD发生率为21.5%,与既往研究[1]结果相一致。
本研究logistic回归分析结果表明,SUA升高为POD的危险因素。进一步经ROC曲线分析得出,SUA可预测患者POD的发生。大量研究调查了尿酸与POD或认知障碍之间的关系,但是研究结果并不一致。一些研究认为SUA升高具有有益影响[11,19,20,21,22],也有研究发现高尿酸血症与脑白质萎缩和认知能力下降有关[23,24,25]。在一项前瞻性大型队列研究中,研究者对4 618名55岁及以上的参与者进行了调查,结果示SUA升高与痴呆风险降低和晚年认知功能较好有关[21]。与上述研究相反,鹿特丹队列研究中发现SUA越高,脑容量尤其是脑白质体积越小,整体认知功能越差[25]。此外,另一项研究从Brisighella心脏研究历史队列中选取288名健康老年人[年龄(69±6)岁],采用MMSE评估其认知功能,发现SUA与认知功能障碍之间呈正相关[24]。虽然目前关于SUA升高引起认知功能下降的具体原因尚不明确,但仍有部分证据能说明其潜在机制。高尿酸血症与脑白质萎缩和脑缺血有关[25,26],还能增加血管损伤风险[27,28],从而引起认知功能障碍。同时,尿酸具有强大的促氧化作用,可打破机体促氧化与抗氧化之间的平衡[29,30],导致细胞或组织器官病理性改变。此外,尿酸可通过TLR4/NF-κB信号通路引起海马炎症,导致认知功能障碍[31]。
本研究中介效应分析结果表明,在SUA与POD的关联中,CSF p-tau和t-tau浓度中介效应显著。尿酸可引起氧化与抗氧化失衡,从而使机体产生氧化应激反应[29]。而氧化应激能增强tau蛋白诱导的神经退行性变[32],此外,慢性氧化应激还可增加tau蛋白的磷酸化[33]。因此,尿酸对tau蛋白的影响可通过氧化应激这一机制进行解释。
本研究存在以下局限性。首先,对受试对象的随访时间较短,不能观察其病程的远期发展。其次,样本量较小,后续研究可适当增加样本量。影像学相关指标的纳入能帮助更好地进行观察研究。除了CSF生物标志物外,还可检测血浆生物标志物水平及变化,同时加入动物模型,探讨高SUA引起POD的机制。
综上所述,术前SUA升高是POD的危险因素,预测POD的准确性较高,CSF p-tau和t-tau浓度是SUA影响POD的中介因子。
临床试验注册:中国临床试验注册中心,ChiCTR2000033439
Trial registration: Chinese Clinical Trial Registry, ChiCTR2000033439