关键词:淋巴瘤;华中科技大学同济医学院附属协和医院登记号:CTR20213390
企业信息:南京征祥医药有限公司
通俗题目:一项评估ZX-101A治疗复发/难治性血液系统恶性肿瘤患者的I/II期研究
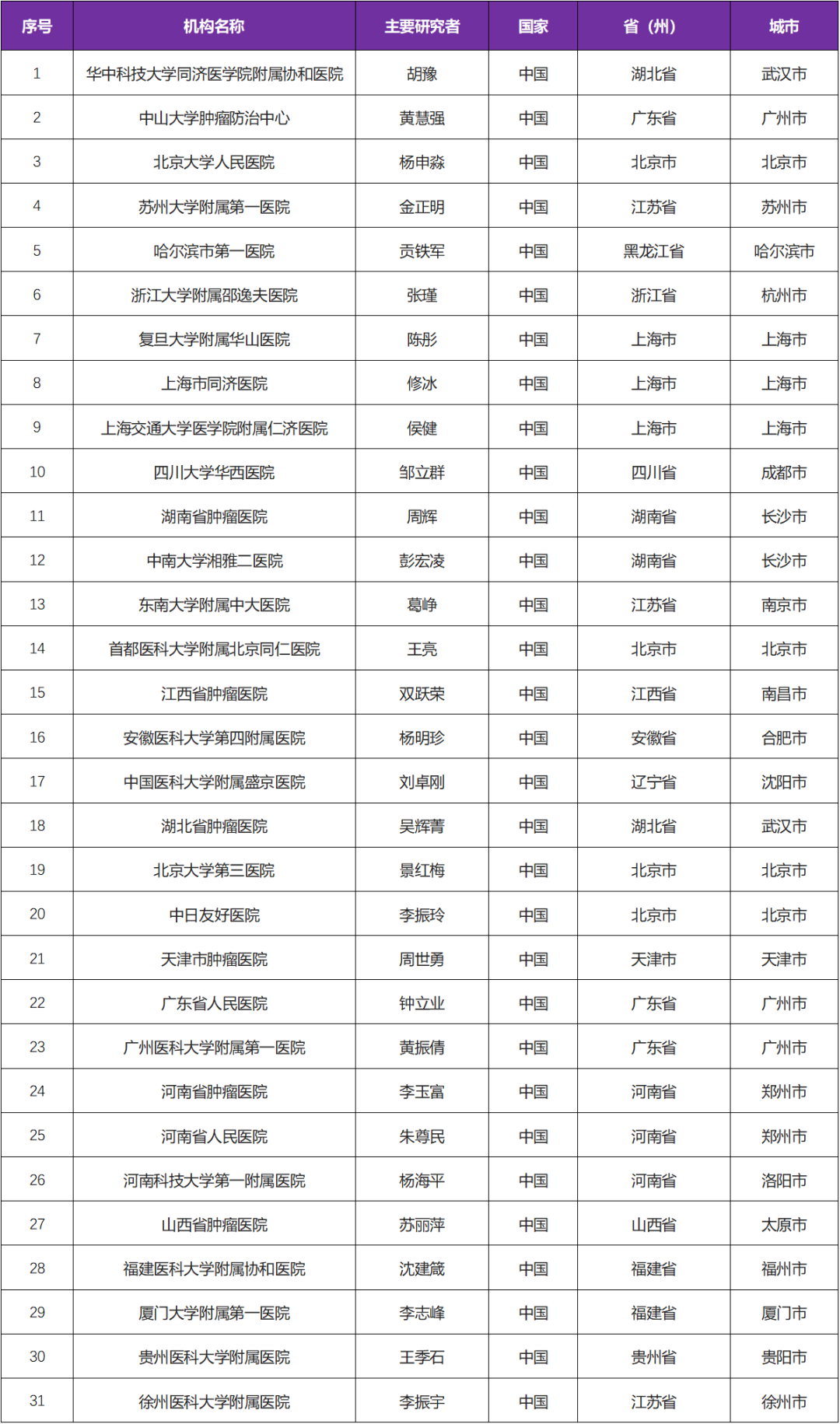
本次临床试验国内主要研究者由 华中科技大学同济医学院附属协和医院胡豫教授牵头,该试验是国内多中心试验,参研机构有国内 31 家医院【简要入排】:
1.年龄≥18岁,男女不限,ECOG评分为0-1分2.经组织学/细胞学确诊的晚期恶性肿瘤:a) I期剂量递增阶段:根据世界卫生组织(WHO)2016分类的复发/难治性血液系统恶性肿瘤,包括外周T细胞淋巴瘤,CLL/小淋巴细胞性淋巴瘤(SLL),及其他非霍奇金淋巴瘤(NHL);b) I期剂量扩展阶段将按照2个队列分别纳入复发/难治性PTCL或B-NHL,II期研究将基于I期研究结果确定纳入复发/难治性PTCL,或者B-NHL中某一潜在亚型患者。外周T细胞淋巴瘤患者既往接受过至少1次标准治疗后进展,B-NHL患者既往治疗要求将基于其亚型确定(CLL/SLL患者,需至少接受过1次标准治疗后进展,其他B-NHL患者既往接受过至少2次标准治疗后进展)3.I期剂量扩展阶段及II期研究要求至少有1个可测量病灶4.足够的骨髓功能:a) 中性粒细胞绝对计数(ANC)> 1.0×109/L;b) 血红蛋白水平≥ 80 g/L(如果血红蛋白降低是因为骨髓受累所致,则≥ 60 g/L);c) 血小板计数≥ 75×109/L(如果血小板减少症是因骨髓受累所致,则≥ 50×109/L)5.足够的器官功能:a) 肾脏:根据机构标准实践评估计算的肌酐清除率≥60 mL/min(根据Cockcroft-Gault 公式);b) 肝脏:AST和ALT≤ 2.5×正常值上限(ULN)(肝脏受累受试者AST和ALT≤ 4×ULN);总胆红素≤ 1.5×ULN(患有Gilbert综合征受试者总胆红素≤ 3×ULN)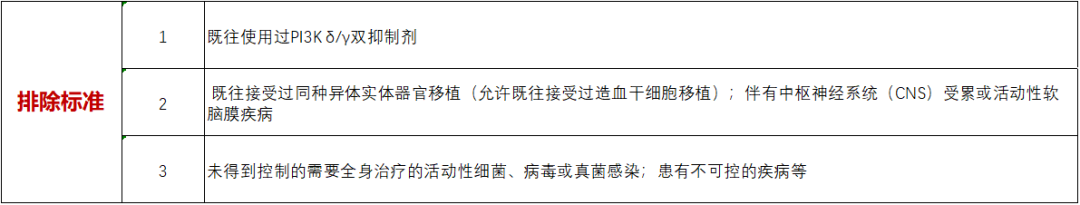
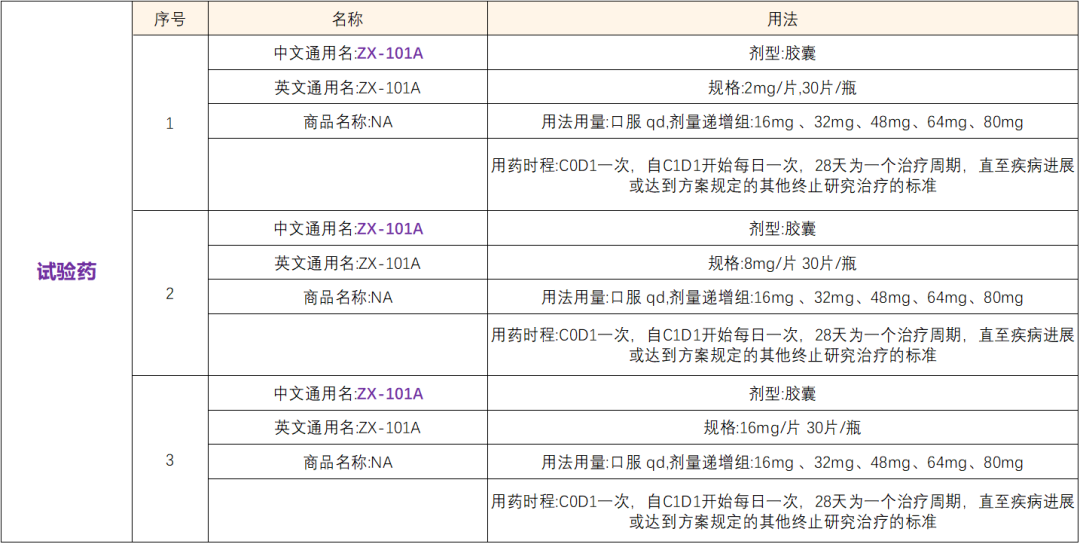
【试验分组】:
非随机 开放 单臂试验 国内试验 I/II期
【治疗/干预方法】
三、参研中心(知名三甲医院)
以上信息来自CDE平台,网址为http://www.chinadrugtrials.org.cn
输入编号为:CTR20200806 即可查询
2,本公众号所刊发、转载的文章,其观点、内容、字体、图片版权均归原作者所有,相关责任作者自负。

通过新药研发信息的传递,我们希望能给失望的朋友以更多期待,给绝望的患者以坚持的力量。
(更多受试者招募信息,关注👆)
欢迎咨询在线筛查;@受试者招募助手

(🔺扫描,直接和招募助手沟通)